题目内容
在某未知溶液中再溶入CH3COONa晶体,测得[Na+]与[CH3COO-]几乎相等,则原溶液可能是( )
| A、HCl溶液 |
| B、NaOH溶液 |
| C、KCl溶液 |
| D、KOH溶液 |
考点:影响盐类水解程度的主要因素
专题:盐类的水解专题
分析:在某未知溶液中再溶入CH3COONa晶体,测得[Na+]与[CH3COO-]几乎相等,说明溶液中离子抑制醋酸根离子水解;
解答:
解:A、HCl溶液溶入CH3COONa晶体,反应生成醋酸和氯化钠,[Na+]与[CH3COO-]一定不相等,故A错误;
B、NaOH溶液溶入CH3COONa晶体,清液离子抑制醋酸根离子水解,但增大了钠离子浓度,[Na+]与[CH3COO-]一定不相等,故B错误;
C、KCl溶液溶入CH3COONa晶体,醋酸根离子水解,离子浓度为[Na+]>[CH3COO-],故C错误;
D、KOH溶液溶入CH3COONa晶体,氢氧根离子抑制醋酸根离子水解,使离子浓度为[Na+]=[CH3COO-],故D正确;
故选D.
B、NaOH溶液溶入CH3COONa晶体,清液离子抑制醋酸根离子水解,但增大了钠离子浓度,[Na+]与[CH3COO-]一定不相等,故B错误;
C、KCl溶液溶入CH3COONa晶体,醋酸根离子水解,离子浓度为[Na+]>[CH3COO-],故C错误;
D、KOH溶液溶入CH3COONa晶体,氢氧根离子抑制醋酸根离子水解,使离子浓度为[Na+]=[CH3COO-],故D正确;
故选D.
点评:本题考查了电解质溶液中离子浓度大小的比较分析判断,盐类水解的影响因素分析应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是( )
| A、通常状况下,干燥的氯气能和Fe反应 |
| B、红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状 |
| D、氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
常温下,下列各组数据中比值为2:1的是( )
| A、Na2O2晶体中阴阳离子个数比2:1 |
| B、0.2mol?L-1的CH3COOH溶液与0.1mol?L-1CH3COOH溶液中c(H+)之比 |
| C、pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 |
| D、pH=11的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A、增加压强 |
| B、降低温度 |
| C、增大CO的浓度 |
| D、更换催化剂 |
某元素的一个原子形成的离子可表示为
Xn-,下列说法正确的是( )
b a |
A、
| ||
B、
| ||
C、X原子的质量数为
| ||
D、X原子的质量约为
|
1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol?l-1和0.4mol?l-1.若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
| A、2.4g | B、3.2g |
| C、6.4g | D、9.6g |

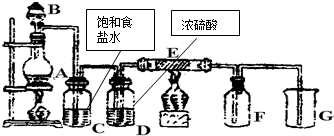 如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.
如图是实验室制取并收集Cl2的装置.A是Cl2发生装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.