题目内容
常温下,下列各组数据中比值为2:1的是( )
| A、Na2O2晶体中阴阳离子个数比2:1 |
| B、0.2mol?L-1的CH3COOH溶液与0.1mol?L-1CH3COOH溶液中c(H+)之比 |
| C、pH=7的氨水与(NH4)2SO4的混合溶液中,c(NH4+)与c(SO42-)之比 |
| D、pH=11的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
考点:电解质在水溶液中的电离,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.Na2O2晶体中阳离子为Na+、阴离子为O22-;
B.CH3COOH为弱电解质,浓度越小,电离程度越大;
C.根据电荷守恒分析;
D.根据pH和Kw求出氢氧根离子的浓度再比较;
B.CH3COOH为弱电解质,浓度越小,电离程度越大;
C.根据电荷守恒分析;
D.根据pH和Kw求出氢氧根离子的浓度再比较;
解答:
解:A.Na2O2晶体中阳离子为Na+、阴离子为O22-,所以Na2O2晶体中阴阳离子个数之比为1:2,故A错误;
B.CH3COOH为弱电解质,浓度越小,电离程度越大,则0.2mol?L-1的CH3COOH溶液与0.1mol?L-1CH3COOH溶液中c(H+)之比小于2:1,故B错误;
C.pH=7的氨水与(NH4)2SO4的混合溶液中,溶液中的电荷守恒:c(NH4+)+C(H+)=c(OH-)+2c(SO42-),当pH=7时,溶液显示中性,则氢离子和氢氧根浓度相等,所以c(NH4+)=2c(SO4 2-),则c(NH4+)与c(SO42-)之比为2:1,故C正确;
D.pH=11的Ba(OH)2溶液中c(OH-)=10-3mol/L,氢氧化钡的浓度为
×10-3mol/L,pH=12的KOH溶液中c(OH-)=10-2mol/L=c(KOH),则溶质的物质的量浓度之比为1:20,故D错误.
故选C.
B.CH3COOH为弱电解质,浓度越小,电离程度越大,则0.2mol?L-1的CH3COOH溶液与0.1mol?L-1CH3COOH溶液中c(H+)之比小于2:1,故B错误;
C.pH=7的氨水与(NH4)2SO4的混合溶液中,溶液中的电荷守恒:c(NH4+)+C(H+)=c(OH-)+2c(SO42-),当pH=7时,溶液显示中性,则氢离子和氢氧根浓度相等,所以c(NH4+)=2c(SO4 2-),则c(NH4+)与c(SO42-)之比为2:1,故C正确;
D.pH=11的Ba(OH)2溶液中c(OH-)=10-3mol/L,氢氧化钡的浓度为
| 1 |
| 2 |
故选C.
点评:本题考查盐类水解及弱电解质的电离,题目难度中等,注意盐类的水解、弱电解质的电离特点,以及从溶液电中性的角度比较离子浓度关系.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
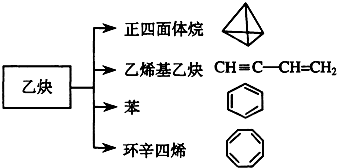

| A、正四面体烷的二氯取代产物有2种 |
| B、正四面体烷与乙烯基乙炔互为同分异构体 |
| C、苯与环辛四烯互为同系物 |
| D、等质量的苯与环辛四烯完全燃烧消耗氧气量不相同 |
酸性H2CO3>HClO>HCO3-,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| A、c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
| B、c(HCO3-)>c(ClO-)>c(OH-) |
| C、c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| D、c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-) |
将足量CO2通入下列各溶液中,所含离子还能大量共存的是( )
| A、K+、SiO32-、Cl-、NO3- |
| B、H+、NH4+、Al3+、SO42- |
| C、Na+、S2-、OH-、SO42- |
| D、Na+、C6H5O-、CH3COO-、HCO3- |
在某未知溶液中再溶入CH3COONa晶体,测得[Na+]与[CH3COO-]几乎相等,则原溶液可能是( )
| A、HCl溶液 |
| B、NaOH溶液 |
| C、KCl溶液 |
| D、KOH溶液 |
在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离程度增大,H+ 浓度减小,可采用方法是( )
| A、加热 |
| B、加入0.1mol/L 的醋酸溶液100mL |
| C、加入少量的0.5mol/L的硫酸 |
| D、加入少量1mol/L 的NaOH溶液 |
把镁条放入盛有过量盐酸的试管中,不影响氢气产生速率的是( )
| A、盐酸的浓度 |
| B、镁条的表面积 |
| C、加少量Na2SO4固体 |
| D、溶液的温度 |
下列关于胶体的叙述中不正确的是( )
| A、丁达尔现象可用来区别胶体与溶液 |
| B、胶体粒子能通过半透膜,不能通过滤纸 |
| C、胶体不稳定,在一定条件下会发生聚沉 |
| D、溶液、胶体、浊液的根本区别是分散质粒子直径的大小 |