题目内容
从明矾[KAl(SO4)2?12H2O]制备Al、K2SO4和H2SO4的流程如下:
明矾焙烧的化学方程式为:4KAl(SO4)2?12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是 .
(2)步骤②中,为提高浸出率,可采取的措施有 .
A.粉碎固体混合物 B.降低温度C.不断搅拌 D.缩短浸泡时间
(3)从水浸后的滤液中得到K2SO4晶体的方法是 .
(4)步骤③电解的化学方程式是 ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是: .
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是 .
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2 的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式).

明矾焙烧的化学方程式为:4KAl(SO4)2?12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是
(2)步骤②中,为提高浸出率,可采取的措施有
A.粉碎固体混合物 B.降低温度C.不断搅拌 D.缩短浸泡时间
(3)从水浸后的滤液中得到K2SO4晶体的方法是
(4)步骤③电解的化学方程式是
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2 的转化率为96%,可生产质量分数为98%的H2SO4质量为
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:从明矾[KAl(SO4)2?12H2O]制备Al、K2SO4和H2SO4的流程:过程①明矾和硫焙烧,4KAl(SO4)2?12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,气体二氧化硫与氧气在五氧化二矾作催化剂的作用下生成三氧化硫,三氧化硫用98.3%的浓硫酸吸收,SO3+H2O=H2SO4,制得硫酸;过程②焙烧所得固体混合物,用水浸,为提高浸出率,可采取粉碎固体混合物、不断搅拌,从水浸后的滤液中蒸发结晶得到K2SO4晶体,步骤③电解Al2O3,制得Al.
(1)依据化学方程式中元素化合价变化分析判断,元素化合价降低的做氧化剂,元素化合价升高的做还原剂;(2)矿石的颗粒大小、温度及是否搅拌等会影响浸取率;
(3)从水浸后的滤液中得到K2SO4晶体运用蒸发溶剂水的方法得到;
(4)步骤③电解Al2O3,制得Al,阳极材料需要定期地进行更换,原因是该极材料不断被消耗;
(5)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应;
(6)依据硫元素守恒计算得到.
(1)依据化学方程式中元素化合价变化分析判断,元素化合价降低的做氧化剂,元素化合价升高的做还原剂;(2)矿石的颗粒大小、温度及是否搅拌等会影响浸取率;
(3)从水浸后的滤液中得到K2SO4晶体运用蒸发溶剂水的方法得到;
(4)步骤③电解Al2O3,制得Al,阳极材料需要定期地进行更换,原因是该极材料不断被消耗;
(5)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应;
(6)依据硫元素守恒计算得到.
解答:
解:从明矾[KAl(SO4)2?12H2O]制备Al、K2SO4和H2SO4的流程:过程①明矾和硫焙烧,4KAl(SO4)2?12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,气体二氧化硫与氧气在五氧化二矾作催化剂的作用下生成三氧化硫,三氧化硫用98.3%的浓硫酸吸收,SO3+H2O=H2SO4,制得硫酸;过程②焙烧所得固体混合物,用水浸,为提高浸出率,可采取粉碎固体混合物、不断搅拌,从水浸后的滤液中蒸发结晶得到K2SO4晶体,步骤③电解Al2O3,制得Al.
(1)4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应中,硫单质硫元素化合价0价,升高到SO2中为+4价,硫酸根离子中硫元素化合价从+6价变化为SO2中+4价,则S为还原剂,被氧化,KAl(SO4)2?12H2O为氧化剂,被还原,
故答案为:KAl(SO4)2?12H2O;
(2)由于酸浸时矿石颗粒大小影响浸取率,可以通过粉碎矿石提高浸取率,还可以适当升高温度或者搅拌提高浸取率,
故答案为:AC;
(3)从水浸后的滤液中得到K2SO4晶体运用蒸发结晶的方法得到,需要蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发结晶;
(4)电解熔融氧化铝,阳极氯离子放电生成氯气,阴极是铝离子放电生成铝,反应的化学方程式为2Al2O3
4Al+3O2↑,在冶炼过程中,阳极材料碳被氧气氧化成一氧化碳,反应为C+O2
CO2或2C+O2
2CO,所以需定期地进行更换,
故答案为:2Al2O3
4Al+3O2↑;阳极中碳被氧化成CO2(CO);
(5)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应,电极方程式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,
故答案为:NiO(OH)+H2O+e-═Ni(OH)2+OH-;
(6)焙烧a吨明矾(摩尔质量为b g/mol),4KAl(SO4)2?12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,生成SO2物质的量为
×
,SO2 的转化率为96%,物质的量为
×
×96%,可生产质量分数为98%的H2SO4质量为
×
×96%×
=
=
,
故答案为:
×
×96%×
=
=
.
(1)4KAl(SO4)2?12H2O+3S═2K2SO4+2Al2O3+9SO2+48H2O反应中,硫单质硫元素化合价0价,升高到SO2中为+4价,硫酸根离子中硫元素化合价从+6价变化为SO2中+4价,则S为还原剂,被氧化,KAl(SO4)2?12H2O为氧化剂,被还原,
故答案为:KAl(SO4)2?12H2O;
(2)由于酸浸时矿石颗粒大小影响浸取率,可以通过粉碎矿石提高浸取率,还可以适当升高温度或者搅拌提高浸取率,
故答案为:AC;
(3)从水浸后的滤液中得到K2SO4晶体运用蒸发结晶的方法得到,需要蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发结晶;
(4)电解熔融氧化铝,阳极氯离子放电生成氯气,阴极是铝离子放电生成铝,反应的化学方程式为2Al2O3
| ||
| 970℃电解 |
| ||
| ||
故答案为:2Al2O3
| ||
| 970℃电解 |
(5)放电时NiO(OH)转化为Ni(OH)2,Ni元素化合价降低,被还原,应为原电池正极反应,电极方程式为NiO(OH)+H2O+e-═Ni(OH)2+OH-,
故答案为:NiO(OH)+H2O+e-═Ni(OH)2+OH-;
(6)焙烧a吨明矾(摩尔质量为b g/mol),4KAl(SO4)2?12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O,生成SO2物质的量为
| a×106g |
| bg/mol |
| 9mol |
| 4mol |
| a×106g |
| bg/mol |
| 9mol |
| 4mol |
| a×106g/t |
| bg/mol |
| 9mol |
| 4mol |
| 98g/mol |
| 98%×106g/t |
| 9mol×98g/mol×96%×a |
| 4mol×bg/mol×98% |
| 216a |
| b |
故答案为:
| a×106g/t |
| bg/mol |
| 9mol |
| 4mol |
| 98g/mol |
| 98%×106g/t |
| 9mol×98g/mol×96%×a |
| 4mol×bg/mol×98% |
| 216a |
| b |
点评:本题以铝的化合物为载体考查了物质间的反应、物质的分离和提纯等知识点,明确物质之间的反应是解本题关键,再结合原子守恒来分析解答,这种综合性较强的题型是高考热点,需利用基础知识细心分析解答,题目难度中等.

练习册系列答案
相关题目
温室时,将浓度和体积分别为C1、V1的NaOH溶液和C2、V2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是( )
| A、若pH>7时,则一定是C1V1=C2V2 |
| B、在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C、当pH=7时,若V1=V2,则一定是C2<C1 |
| D、若V1=V2,C1=C2,则C(CH3COO-)+C(CH3COOH)=C(Na+) |
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
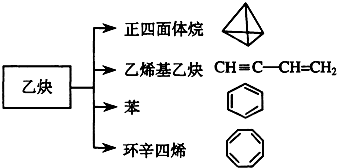

| A、正四面体烷的二氯取代产物有2种 |
| B、正四面体烷与乙烯基乙炔互为同分异构体 |
| C、苯与环辛四烯互为同系物 |
| D、等质量的苯与环辛四烯完全燃烧消耗氧气量不相同 |
某烯烃与H2加成后的产物如图所示,则该烯烃的结构式可能有( )


| A、1种 | B、2种 | C、3种 | D、4种 |
在某未知溶液中再溶入CH3COONa晶体,测得[Na+]与[CH3COO-]几乎相等,则原溶液可能是( )
| A、HCl溶液 |
| B、NaOH溶液 |
| C、KCl溶液 |
| D、KOH溶液 |

 (1)立方烷的结构简式如图1所示,每个顶点是一个碳原子.则:
(1)立方烷的结构简式如图1所示,每个顶点是一个碳原子.则: 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.