题目内容
细菌冶金是近年来新兴的绿色冶金工艺,它主要是应用细菌法溶浸贫矿、废矿、尾矿和炉渣等,以回收某些贵重有色金属和稀有金属,节约矿产资源,最大限度地利用矿藏的一种冶金方法.其中细菌冶铜的生产流程为:
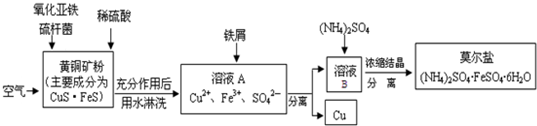
(1)上述生产流程中有两步都涉及了同一种分离方法,实验室中不能用这种分离方法来分离液态胶体的原因是 .
(2)莫尔盐是一种标定氧化剂浓度的基准物质.在溶液B中加入(NH4)2SO4晶体析出莫尔盐的原因 .
(3)在溶液A中加入铁屑,反应后若固体中只有Cu,则所得的溶液中一定含有的阳离子是 ;不可能含有的阳离子是 .
(4)写出CuS?FeS在氧化亚铁硫杆菌(Thiobacillus ferrooxidans,简写为T.f)作用下被空气氧化生成溶液A的离子方程式 .
(5)氧化亚铜可用作船底防污漆,以杀死低级海生动物而保护船体,可用作陶瓷和搪瓷的着色剂和红色玻璃的染色剂,氧化亚铜也是一种重要的半导体材料.请用浓的强碱性溶液,根据2Cu+H2O═Cu2O+H2↑反应,设计出工业生产氧化亚铜的一种方法(只要求画实验装置图,其他必要材料任选) .

(1)上述生产流程中有两步都涉及了同一种分离方法,实验室中不能用这种分离方法来分离液态胶体的原因是
(2)莫尔盐是一种标定氧化剂浓度的基准物质.在溶液B中加入(NH4)2SO4晶体析出莫尔盐的原因
(3)在溶液A中加入铁屑,反应后若固体中只有Cu,则所得的溶液中一定含有的阳离子是
(4)写出CuS?FeS在氧化亚铁硫杆菌(Thiobacillus ferrooxidans,简写为T.f)作用下被空气氧化生成溶液A的离子方程式
(5)氧化亚铜可用作船底防污漆,以杀死低级海生动物而保护船体,可用作陶瓷和搪瓷的着色剂和红色玻璃的染色剂,氧化亚铜也是一种重要的半导体材料.请用浓的强碱性溶液,根据2Cu+H2O═Cu2O+H2↑反应,设计出工业生产氧化亚铜的一种方法(只要求画实验装置图,其他必要材料任选)
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:向黄铜矿粉中加入稀硫酸、氧化亚铁硫杆菌、空气,发生反应,离子方程式为4CuS?FeS+17O2+4H+═4Cu2++4Fe3++8SO42-+2H2O,向溶液A中加入铁屑,发生反应Cu2++Fe=Fe2++Cu、2Fe3++Fe=3Fe2+,然后过滤得到Cu和溶液,向溶液中加入(NH4)2SO4,然后蒸发浓缩、冷却结晶得到莫尔盐,
(1)上述生产流程中有两步都涉及了同一种分离方法为过滤,难溶性固体不能透过滤纸和半透膜,胶体能透过滤纸但不能透过半透膜;
(2)在溶液B中加入(NH4)2SO4晶体析出莫尔盐的原因是反应体系中莫尔盐的溶解度最小;
(3)铁和Cu2+、Fe3+反应生成Fe2+,有Cu生成,则溶液中一定没有Fe3+;
(4)CuS?FeS在氧化亚铁硫杆菌(Thiobacillus ferrooxidans,简写为T.f)作用下被空气氧化生成铜离子、铁离子、硫酸根离子和水;
(5)2Cu+H2O═Cu2O+H2↑不能自发进行,要使该反应能发生,应该设计成电解池,且Cu作阳极,浓NaOH溶液作电解质溶液.
(1)上述生产流程中有两步都涉及了同一种分离方法为过滤,难溶性固体不能透过滤纸和半透膜,胶体能透过滤纸但不能透过半透膜;
(2)在溶液B中加入(NH4)2SO4晶体析出莫尔盐的原因是反应体系中莫尔盐的溶解度最小;
(3)铁和Cu2+、Fe3+反应生成Fe2+,有Cu生成,则溶液中一定没有Fe3+;
(4)CuS?FeS在氧化亚铁硫杆菌(Thiobacillus ferrooxidans,简写为T.f)作用下被空气氧化生成铜离子、铁离子、硫酸根离子和水;
(5)2Cu+H2O═Cu2O+H2↑不能自发进行,要使该反应能发生,应该设计成电解池,且Cu作阳极,浓NaOH溶液作电解质溶液.
解答:
解:向黄铜矿粉中加入稀硫酸、氧化亚铁硫杆菌、空气,发生反应,离子方程式为4CuS?FeS+17O2+4H+═4Cu2++4Fe3++8SO42-+2H2O,向溶液A中加入铁屑,发生反应Cu2++Fe=Fe2++Cu、2Fe3++Fe=3Fe2+,然后过滤得到Cu和溶液,向溶液中加入(NH4)2SO4,然后蒸发浓缩、冷却结晶得到莫尔盐,
(1)上述生产流程中有两步都涉及了同一种分离方法为过滤,难溶性固体不能透过滤纸和半透膜,胶体能透过滤纸但不能透过半透膜,所以实验室中不能用过量分离方法来分离液态胶体,故答案为:胶体的分散质(或胶体粒子)能通过滤纸孔隙;
(2)在溶液B中加入(NH4)2SO4晶体析出莫尔盐的原因是反应体系中莫尔盐的溶解度最小,故答案为:反应体系中莫尔盐的溶解度最小;
(3)铁和Cu2+、Fe3+反应生成Fe2+,Cu和Fe3+反应生成Fe2+,有Cu生成,则溶液中一定没有Fe3+,一定有Fe2+,故答案为:Fe2+;Fe3+;
(4)CuS?FeS在氧化亚铁硫杆菌(Thiobacillus ferrooxidans,简写为T.f)作用下被空气氧化生成铜离子、铁离子、硫酸根离子和水,离子方程式为4CuS?FeS+17O2+4H+═4Cu2++4Fe3++8SO42-+2H2O,故答案为:4CuS?FeS+17O2+4H+═4Cu2++4Fe3++8SO42-+2H2O;
(5)2Cu+H2O═Cu2O+H2↑不能自发进行,要使该反应能发生,应该设计成电解池,且Cu作阳极,浓NaOH溶液作电解质溶液,图象为 ,故答案为:
,故答案为: .
.
(1)上述生产流程中有两步都涉及了同一种分离方法为过滤,难溶性固体不能透过滤纸和半透膜,胶体能透过滤纸但不能透过半透膜,所以实验室中不能用过量分离方法来分离液态胶体,故答案为:胶体的分散质(或胶体粒子)能通过滤纸孔隙;
(2)在溶液B中加入(NH4)2SO4晶体析出莫尔盐的原因是反应体系中莫尔盐的溶解度最小,故答案为:反应体系中莫尔盐的溶解度最小;
(3)铁和Cu2+、Fe3+反应生成Fe2+,Cu和Fe3+反应生成Fe2+,有Cu生成,则溶液中一定没有Fe3+,一定有Fe2+,故答案为:Fe2+;Fe3+;
(4)CuS?FeS在氧化亚铁硫杆菌(Thiobacillus ferrooxidans,简写为T.f)作用下被空气氧化生成铜离子、铁离子、硫酸根离子和水,离子方程式为4CuS?FeS+17O2+4H+═4Cu2++4Fe3++8SO42-+2H2O,故答案为:4CuS?FeS+17O2+4H+═4Cu2++4Fe3++8SO42-+2H2O;
(5)2Cu+H2O═Cu2O+H2↑不能自发进行,要使该反应能发生,应该设计成电解池,且Cu作阳极,浓NaOH溶液作电解质溶液,图象为
 ,故答案为:
,故答案为: .
.
点评:本题考查物质分离和提纯,涉及离子方程式的书写、电解池设计、氧化还原反应等知识点,明确物质性质是解本题关键,根据实验目的及反应方程式设计电解池,难点是(3)中离子反应先后顺序,题目难度中等.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
1mol某烃能与2molHCl完全加成,其产物最多能被6molCl2完全取代,则原烃可能为( )
| A、乙炔 |
| B、1,3-丁二烯 |
| C、1-丙炔 |
| D、1,3-环己二烯 |
下列有关实验的做法错误的是( )
| A、用四氯化碳萃取溴水中的溴后,分液时,有机层应从分液漏斗的上口倒出 |
| B、检验NH4+时,向试样中加入NaOH溶液并加热,用湿润红色石蕊试纸检验逸出的气体 |
| C、用分液漏斗滴加溶液时,应打开上口的玻璃塞或将玻璃塞上的凹槽对准口颈部的小孔 |
| D、玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下 |
实验室里取用金属钠时,用到的仪器用品是( )
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤试管 ⑥玻璃棒 ⑦药匙 ⑧玻璃片或培养皿.
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤试管 ⑥玻璃棒 ⑦药匙 ⑧玻璃片或培养皿.
| A、①③⑤⑦ | B、②④⑦⑧ |
| C、③④⑤⑧ | D、②③④⑧ |
下列各组括号内的试剂,不能用于除掉物质中杂质的是( )
| A、Fe粉中混有Al粉杂质(稀H2SO4) |
| B、FeCl3中混有FeCl2杂质(Cl2) |
| C、CO气体中混有CO2杂质(NaOH溶液) |
| D、SiO2中混有CaCO3杂质(盐酸) |
反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎没影响的是( )
| A、增加C的量 |
| B、将容器的体积缩小一半 |
| C、投入一块钠 |
| D、保持压强不变,充入Ar使容器容积变大 |