题目内容
高锰酸钾是强氧化剂,它的用途遍布各个行业.
(1)工业上由软锰矿(主要成分为Mn02)生产髙锰酸钾分为两个步骤:
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2Mn04),该反应的化学方程式是
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2Mn04)溶液,在 (填“阴极区”或“阳极区”)得到高锰酸钾.阴极反应的化学方程式是 .
(2)某研究小组用工业生产高锰酸钾产生的废渣--猛泥(含K2Mn04、Mn02及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:
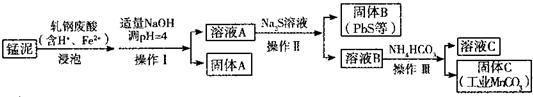
③轧钢废酸中Fe2+的作用是 .
④操作I、操作Ⅱ、操作Ⅲ的名称是 .
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是
⑥若固体C中不含CaCO3,则溶液D中
< .
(已知:Ksp(MnCO3)=1×10-11Ksp(CaCO3)=5×10-9)
(1)工业上由软锰矿(主要成分为Mn02)生产髙锰酸钾分为两个步骤:
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2Mn04),该反应的化学方程式是
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2Mn04)溶液,在
(2)某研究小组用工业生产高锰酸钾产生的废渣--猛泥(含K2Mn04、Mn02及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:

③轧钢废酸中Fe2+的作用是
④操作I、操作Ⅱ、操作Ⅲ的名称是
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是
⑥若固体C中不含CaCO3,则溶液D中
| c(Ca2+) |
| c(Mn2+) |
(已知:Ksp(MnCO3)=1×10-11Ksp(CaCO3)=5×10-9)
考点:物质分离和提纯的方法和基本操作综合应用,电解原理
专题:电化学专题,元素及其化合物
分析:(1)①将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2Mn04),结合原子守恒配平书写化学方程式;
②电解锰酸钾(K2Mn04)溶液,得到高锰酸钾,结合锰元素化合价变化+6价变化为+7价,失电子发生氧化还原反应,阴极上是溶液中氢离子得到电子生成氢气;
(2)猛泥(含K2Mn04、Mn02及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),锰泥和轧钢废液浸泡,其中轧钢废酸中Fe2+的作用是还原K2Mn04、Mn02为锰离子,加入适量氢氧化钠调节溶液PH=4,过滤得到溶液A和固体A,溶液A中加入硫化钠溶液反应得到固体B为PbS沉淀,滤液B加入碳酸氢铵溶液过滤得到固体C碳酸锰;
③亚铁离子具有还原性还原锰元素为锰离子;
④分析流程操作ⅠⅡⅢ都是分离固体和液体的操作,用 过滤操作分离;
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是K+、Na+、NH4+;
⑥依据碳酸钙和碳酸锰共存,结合溶度积常数计算分析;
②电解锰酸钾(K2Mn04)溶液,得到高锰酸钾,结合锰元素化合价变化+6价变化为+7价,失电子发生氧化还原反应,阴极上是溶液中氢离子得到电子生成氢气;
(2)猛泥(含K2Mn04、Mn02及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),锰泥和轧钢废液浸泡,其中轧钢废酸中Fe2+的作用是还原K2Mn04、Mn02为锰离子,加入适量氢氧化钠调节溶液PH=4,过滤得到溶液A和固体A,溶液A中加入硫化钠溶液反应得到固体B为PbS沉淀,滤液B加入碳酸氢铵溶液过滤得到固体C碳酸锰;
③亚铁离子具有还原性还原锰元素为锰离子;
④分析流程操作ⅠⅡⅢ都是分离固体和液体的操作,用 过滤操作分离;
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是K+、Na+、NH4+;
⑥依据碳酸钙和碳酸锰共存,结合溶度积常数计算分析;
解答:
解:(1)①将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2Mn04),结合原子守恒配平书写化学方程式为:2MnO2+4KOH+O2
2K2MnO4+2H2O;
故答案为:2MnO2+4KOH+O2
2K2MnO4+2H2O;
②电解锰酸钾(K2Mn04)溶液,得到高锰酸钾,结合锰元素化合价变化+6价变化为+7价,失电子发生氧化还原反应,所以在阳极区发生反应;阴极上是溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;
故答案为:阳极区,2H++2e-=H2↑;
(2)猛泥(含K2Mn04、Mn02及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),锰泥和轧钢废液浸泡,其中轧钢废酸中Fe2+的作用是还原K2Mn04、Mn02为锰离子,加入适量氢氧化钠调节溶液PH=4,过滤得到溶液A和固体A,溶液A中加入硫化钠溶液反应得到固体B为PbS沉淀,滤液B加入碳酸氢铵溶液过滤得到固体C碳酸锰;
③轧钢废酸中Fe2+的作用是,亚铁离子具有还原性,还原锰元素为锰离子;
故答案为:将高价的锰元素还原成Mn2+;
④分析流程操作ⅠⅡⅢ都是分离固体和液体的操作,用过滤操作分离;
故答案为:过滤;
⑤依据流程和加入的试剂分析判断,溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是K+、Na+、NH4+;
故答案为:K+、Na+、NH4+;
⑥依据碳酸钙和碳酸锰共存,结合溶度积常数计计算,则溶液D中
=
=
=500,若固体C中不含CaCO3,则溶液D中
<500;
故答案为:500;
| ||
故答案为:2MnO2+4KOH+O2
| ||
②电解锰酸钾(K2Mn04)溶液,得到高锰酸钾,结合锰元素化合价变化+6价变化为+7价,失电子发生氧化还原反应,所以在阳极区发生反应;阴极上是溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;
故答案为:阳极区,2H++2e-=H2↑;
(2)猛泥(含K2Mn04、Mn02及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),锰泥和轧钢废液浸泡,其中轧钢废酸中Fe2+的作用是还原K2Mn04、Mn02为锰离子,加入适量氢氧化钠调节溶液PH=4,过滤得到溶液A和固体A,溶液A中加入硫化钠溶液反应得到固体B为PbS沉淀,滤液B加入碳酸氢铵溶液过滤得到固体C碳酸锰;
③轧钢废酸中Fe2+的作用是,亚铁离子具有还原性,还原锰元素为锰离子;
故答案为:将高价的锰元素还原成Mn2+;
④分析流程操作ⅠⅡⅢ都是分离固体和液体的操作,用过滤操作分离;
故答案为:过滤;
⑤依据流程和加入的试剂分析判断,溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是K+、Na+、NH4+;
故答案为:K+、Na+、NH4+;
⑥依据碳酸钙和碳酸锰共存,结合溶度积常数计计算,则溶液D中
| c(Ca2+) |
| c(Mn2+) |
| Ksp(CaCO3) |
| Ksp(MgCO3) |
| 5×10-9 |
| 1×10-11 |
| c(Ca2+) |
| c(Mn2+) |
故答案为:500;
点评:本题考查了流程分析,实验基本操作方法,电解原理 分析判断,溶度积常数计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系.下列判断正确的是( )
| A、与NaOH反应的氯气一定为0.3 mol |
| B、若反应中转移的电子为n mol,则0.15<n<0.25 |
| C、n(Na+):n(Cl-)可能为7:3 |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为8:2:1 |
现有AgNO3、Na2CO3和 Na2SO4三种无色溶液,只用一种试剂,一次区别开,则该试剂是( )
| A、BaCl2溶液 |
| B、稀盐酸 |
| C、KOH溶液 |
| D、NaNO3溶液 |
下列说法中正确的是( )
| A、0.1mol/L (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
已知:250C时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11,下列说法正确的是( )
| A、250C 时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B、250C 时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C、250C时,Mg(OH)2固体在20ml0.01mol?L-1氨水中的Ksp比在20mL0.01mol?L-1NH4Cl溶液中的Ksp小 |
| D、250C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
NA为阿伏加德罗常数,下列叙述正确的是( )
| A、12 g金刚石中含有的共价键数为2NA |
| B、22.4LNH3中含有的电子数为10NA |
| C、将1molCl2通入足量水中充分反应达到平衡后转移电子总数为NA |
| D、电解精炼铜时,当电路中转移2NA个电子时粗铜的质量减少64g |

 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: