题目内容
12. 为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.
为了解决空气污染危机,中国煤炭业制定了“煤制气”计划.工业上可用煤生产合成气(CO和H2),也可用煤制天然气.(1)已知:①CO(g)+H2O(g)═H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)═CH4(g)△H=-73kJ•mol-1
③2CO(g)═C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O的热化学方程式:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)利用合成气可制备新型燃料甲醇:CO(g)+2H2(g)?CH3OH(g)△H,下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,将2mol CO和6mol H2充入2L的恒容密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为2CH3OH+3O2+4OH-═2CO32-+6H2O.
分析 (1)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
(2)①从表中数据可以看出,温度升高,K值减小,即温度升高时平衡逆向移动;
②起始时,CO和H2的物质的量浓度分别为1 mol/L和3 mol/L,CO的平衡浓度为0.2 mol/L,计算CO浓度变化量,CO转化率=$\frac{CO浓度变化量}{CO起始浓度}$×100%;利用三段式计算平衡时各物质的浓度,代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算平衡常数,进而判断温度;
(3)该燃料电池中,甲醇发生氧化反应生成CO2和H2O,CO2与OH-反应生成CO32-与水.
解答 解:(1)已知:①CO(g)+H2O(g)═H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)═CH4(g)△H=-73kJ•mol-1
③2CO(g)═C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,由③-①×2+②得:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-171 kJ•mol-1-(-41 kJ•mol-1)×2-73 kJ•mol-1=-162 kJ•mol-1,
故反应热化学方程式为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162 kJ•mol-1,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162 kJ•mol-1;
(2)①从表中数据可以看出,温度升高,K值减小,即温度升高时平衡逆向移动,所以该反应是放热反应,△H<0,
故答案为:<;
②起始时,CO和H2的物质的量浓度分别为$\frac{2mol}{2L}$=1 mol/L和$\frac{6mol}{2L}$=3 mol/L,CO的平衡浓度为0.2 mol/L,则CO的转化浓度为0.8 mol/L,CO转化率为$\frac{0.8}{1}$×100%=80%;
CO(g)+2H2(g)?CH3OH(g)
起始(mol/L):1 3 0
转化(mol/L):0.8 1.6 0.8
平衡(mol/L):0.2 1.4 0.8
则该温度下,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.8}{0.2×1.{4}^{2}}$=2.041,对应的温度是250℃,
故答案为:80%;250℃;
(3)该燃料电池中,甲醇发生氧化反应生成CO2和H2O,CO2与OH-反应生成CO32-与水,电池总反应离子方程式为:2CH3OH+3O2+4OH-═2CO32-+6H2O,
故答案为:2CH3OH+3O2+4OH-═2CO32-+6H2O.
点评 本题属于拼合型题目,涉及热化学方程式书写、平衡常数影响因素及计算、化学平衡计算、电池反应式书写等,侧重考查学生对知识的迁移应用,掌握利用盖斯定律书写热化学方程式与反应热有关计算,难度中等.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案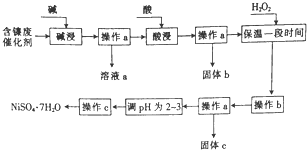 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O,已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| FE(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(2)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+H2O.
(3)操作b为调节溶液的pH,你认为pH的调控范围是3.2-7.1.
(4)溶液a中加入盐酸可制得AlCl3溶液,AlCl3溶液可用于制备聚合氯化铝.聚合氯化铝是一种新型净水剂,其中铝主要以[AlO4Al12(OH)2(H2O)12]2+(用Alb表示)的形式存在.
①写出用溶液a与盐酸反应制备AlCl3的离子方程式:AlO2-+4H+=Al3++2H2O.
②一定条件下,向1.0mol•L-1的AlCl3溶液中加入0.6mol•L-1的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液.写出生成[AlO4Al12(OH)24(H2O)22]2+的离子方程式:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+.
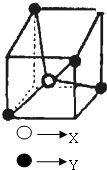
| A. | YX4 | B. | YX2 | C. | YX | D. | XY4 |
(1)科学家一直致力于“人工固氮”的新方法研究.据报道,在光照条件下,N2在催化剂表面与水发生反应生成NH3和另一种单质.在使用催化剂和不使用催化剂时,该反应过程和能量的变化关系如图所示.
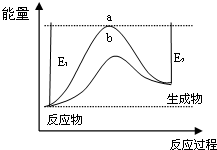
①写出该反应的化学方程式2N2+6H2O$\frac{\underline{\;催化剂\;}}{光照}$4NH3+3O2.
②a和b相比,二者的平衡常数关系是Ka=Kb(填“>”、“=”或“<”).
③升高温度,平衡时NH3的含量增大(填“增大”、“不变”或“减小”).
(2)在 0.5L的密闭容器中,一定量的 N2和H2发生反应:N2(g)+3H2(g)?2NH3(g)△H<0,
400℃时,K=0.5,某一时刻测得N2、H2 和NH3三种物质物质的量分别为2mol、2mol和3mol,则该反应的v正(N2)>v逆(N2)(填“>”“=”或“<”).
(3)将NH3气体通入稀盐酸中,若存在[NH4+]>[Cl-]>[OH-]>[H+]的关系,此时所得溶液的溶质是NH3.H2O、NH4Cl(填化学式).
(4)NH3的催化氧化反应是工业制HNO3的关键步骤,测得某温度下固定容积的容器中的数据为:
| 浓度/mol•L-1 时间 | c(NH3) | c(O2) | c(NO) |
| 0min | 1.000 | 1.600 | 0.000 |
| 2min | 0.600 | a | 0.400 |
| 4min | 0.500 | 0.975 | 0.500 |
| 6min | 0.500 | 0.975 | 0.500 |
| 8min | 0.700 | 1.225 | 0.750 |
②在第8min时改变条件,你认为改变的条件可能是增大NO的浓度.
(1)已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197kJ•mol-1
H2O(g)=H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═2H2S O4(l)△H=-130 kJ/mol.
(2)若反应2H2(g)+O2(g)═2H2O(g ),△H=-241.8kJ•mol-1,根据下表数据.则x=738.2 kJ•mol-1.
| 化学键 | H-H | O═O | O-H |
| 断开1mol化学键所需的能量/kJ | 436 | x | 463 |
①该温度下,在两个容积均为1L的密闭容器中,分别发生该反应:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO (g)和2mol H2(g) | 1mol CH3OH(g) |
| 平衡时c(CH3OH) | c1 | c2 |
| 平衡时能量变化 | 放出54kJ | 吸收a kJ |
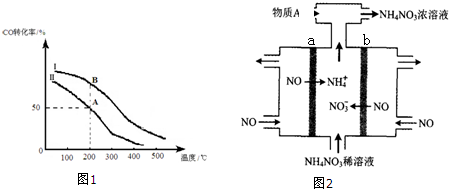
②若密闭容器容积与①相同,Ⅰ、Ⅱ曲线(图1)分别表示投料比不同时的反应过程. 若Ⅱ反应的n(CO)起始=10mol、投料比为0.5,则:A点的平衡常数KA=0.01,B点的平衡常数KB=KA.(填“>”或“<”或“=”)
③为提高CO转化率可采取的措施是减小投料比,降低温度,增大压强,分离出CH3OH等(至少答出两条).
(4)电解NO制备NH4NO3,其工作原理如图2所示,则a电极名称为阴极,b电极反应式为NO+2H2O-3e-=NO3-+4H+.
| A. | 第5周期第IA族 | B. | 第4周期第IA族 | C. | 第3周期第IA族 | D. | 第3周期第IA族 |
| A. | 聚二氧化碳塑料是通过加聚反应制得的 | |
| B. | 聚二氧化碳塑料与干冰互为同素异形体 | |
| C. | 聚二氧化碳塑料与干冰都属于纯净物 | |
| D. | 聚二氧化碳塑料的使用会产生白色污染 |
| A. | 常温下,0.1mol•L-1 Na2S溶液中存在:c(OH-)=c(H+ )+c(HS-)+c(H2S) | |
| B. | PH=3的醋酸溶液中:c(H+ )=c(CH3COO-)=0.3mol•L-1 | |
| C. | 某溶液中由水电离出的c(OH- )=1×10-a mol•L-1,若a>7时,则该溶液的pH可能为a | |
| D. | pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(NH4+ )>c(H+ )>c(OH- ) |
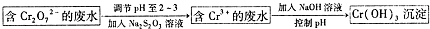
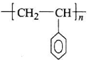
 ),聚苯乙烯的化学式为
),聚苯乙烯的化学式为