题目内容
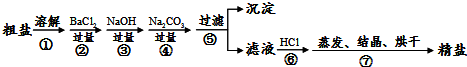
9.在下列给定条件的溶液中,一定能大量共存的离子组是( )| A. | 无色溶液:Ca2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NO3-、I-、AlO2- | |
| C. | FeCl3溶液:K+、Na+、Fe2+、S2- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=0.1mol/L的溶液:Na+、K+、SiO32-、NO3- |
分析 A.氢离子与亚硫酸氢根离子反应;
B.能使pH试纸呈红色的溶液中存在大量氢离子,硝酸根离子在酸性条件下能够氧化碘离子,氢离子与偏铝酸根离子反应;
C.铁离子能够氧化硫离子,亚铁离子与硫离子反应生成硫化亚铁沉淀;
D.该溶液呈碱性,四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.H+、HSO3-之间反应生成二氧化硫气体和水,在溶液中不能大量共存,故A错误;
B.能使pH试纸呈红色的溶液呈酸性,溶液中存在大量氢离子,AlO2-与氢离子反应,NO3-、I-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.Fe3+能够氧化S2-,Fe2+、S2-之间反应生成硫化亚铁沉淀,在溶液中不能大量共存,故C错误;
D.该溶液中存在大量氢氧根离子,Na+、K+、SiO32-、NO3-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
19.某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0.下列叙述中,正确的是( )
| A. | 加入少量W,逆反应速率增大 | |
| B. | 当容器中气体压强不变时,反应达到平衡 | |
| C. | 升高温度,平衡逆向移动 | |
| D. | 改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大 |
20.各取1mol的下列物质与溴水充分反应,消耗Br2的物质的量按①、②、③的顺序排列正确的是( )


| A. | 2 mol、2 mol、6 mol | B. | 5 mol、2 mol、6 mol | ||
| C. | 4 mol、2 mol、5 mol | D. | 3 mol、2 mol、6 mol |
17.下列化学反应的离子方程式书写正确的是( )
| A. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 向氢氧化铜中滴加稀盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 锌粒与稀醋酸反应:Zn+2H+═Zn2++H2↑ |
4.下列液体中,滴入水中会出现分层现象,但在滴入热的氢氧化钠溶液中时分层现象会逐渐消失的是(不考虑有机物的挥发)( )
| A. | 溴乙烷和乙酸乙酯 | B. | 乙醇和乙酸 | ||
| C. | 乙醇和乙酸乙酯 | D. | 苯乙烯和氯甲烷 |
14.常温下,下列盐溶液 pH<7的是( )
| A. | NaHCO3溶液 | B. | NaHSO3溶液 | C. | CH3COONa溶液 | D. | Na2HPO4溶液 |
5.三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备三氯化六氨合钴(Ⅲ)的化学方程式为:
2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O
实验流程如图1:
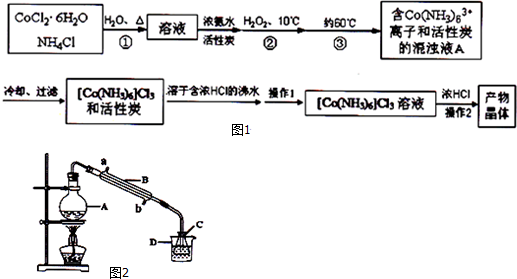
已知:[Co(NH3)6]Cl3 在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
请回答下列问题:
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体,加热煮沸和研细的目的是加速固体溶解.
(2)H2O2的作用是做氧化剂,第③步中保持60℃的加热方法是水浴加热.
(3)过滤是滤纸先用蒸馏水湿润,然后用玻璃棒压实滤纸,排出滤纸与漏斗之间的气泡.
(4)实验操作1为趁热过滤,[Co(NH3)6]Cl3 溶液中加入浓HCl的目的是有利于[Co(NH3)6]Cl3析出,提高产率.
(5)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:
[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl(装置见图2),
C中装0.5000mol/L的盐酸25.00mL,D中装有冰水.加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2~3滴甲基红指示剂,用0.5000mol/L的NaOH滴定.已知:
①仪器A的名称是圆底烧瓶.
②当滴定到终点时,共需消耗NaOH溶液13.00mL(精确到0.01mL)
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将偏大(填“偏大”、“偏小”或“不变”).
2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O
实验流程如图1:

已知:[Co(NH3)6]Cl3 在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
| 温度(℃) | 0 | 20 | 47 |
| 溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体,加热煮沸和研细的目的是加速固体溶解.
(2)H2O2的作用是做氧化剂,第③步中保持60℃的加热方法是水浴加热.
(3)过滤是滤纸先用蒸馏水湿润,然后用玻璃棒压实滤纸,排出滤纸与漏斗之间的气泡.
(4)实验操作1为趁热过滤,[Co(NH3)6]Cl3 溶液中加入浓HCl的目的是有利于[Co(NH3)6]Cl3析出,提高产率.
(5)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:
[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl(装置见图2),
C中装0.5000mol/L的盐酸25.00mL,D中装有冰水.加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2~3滴甲基红指示剂,用0.5000mol/L的NaOH滴定.已知:
| 指示剂 | 颜色 | 变色的pH范围 | ||
| 甲基红 | 红 | 橙 | 黄 | 4.4~6.2 |
②当滴定到终点时,共需消耗NaOH溶液13.00mL(精确到0.01mL)
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将偏大(填“偏大”、“偏小”或“不变”).