题目内容
12.某研究性学习小组利用手持技术探究强碱和不同的酸中和反应的过程如下:(1)实验步骤:
①分别配制250mL浓度均为0.1mol•L-1的NaOH、HCl、CH3COOH、H3PO4溶液备用.配制过程中用到的玻璃仪器有烧杯、胶头滴管、细口瓶、250mL容量瓶、胶头滴管、量筒.
②在锥形瓶中加入10mL 0.1mol•L-1的HCl溶液,在25.00mL碱式(填“酸式”或“碱式”)滴定管中加入0.1mol•L-1的NaOH溶液,连接数据采集器和pH传感器.
③向锥形瓶中滴入NaOH溶液,接近估算的NaOH用量附近时,减慢滴加速度,等读数稳定后,再滴下一滴NaOH溶液.
④存储计算机绘制的pH变化图.用0.1mol•L-1的CH3COOH、H3PO4溶液代替HCl溶液重复上述②~④的操作.
(2)结果分析:20℃时NaOH溶液分别滴定HCl、CH3COOH、H3PO4溶液的pH变化曲线如下.
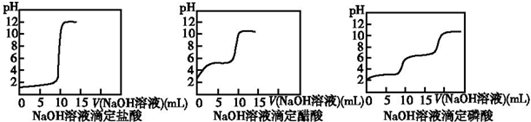
根据上述曲线回答下列问题:
①20℃时,三种酸从强到弱的顺序是盐酸>磷酸>醋酸;
②醋酸恰好中和时pH≈8的原因是(用离子方程式表示)CH3COO-+H2O?CH3COOH+OH-;
③你认为前述的步骤中,NaOH溶液滴定磷酸是否可行?不可行(填“可行”或“不可行”),原因是中和后生成的醋酸钠水解使溶液显碱性.
分析 (1)①根据溶液的配制过程选择仪器;
②NaOH溶液应该用碱式滴定管量取;
(2)根据图象可知酸性越强,其pH变化越快;
②醋酸恰好中和时得到醋酸钠溶液,醋酸根离子水解显示碱性,根据盐类的水解原理分析;
③NaOH滴定磷酸时,消耗NaOH的量多.
解答 解:(1)①根据溶液的配制过程选择仪器,在定容时需要胶头滴管,用到的仪器是:250mL容量瓶、胶头滴管、量筒;故答案为:250mL容量瓶、胶头滴管、量筒;
②NaOH溶液能腐蚀酸式滴定管中的活塞,所以要用碱式滴定管,故答案为:碱式;
(2)①根据图象可知酸性越强,其pH变化越快,所以其酸性由强到若的顺序为:盐酸>磷酸>醋酸,故答案为:盐酸>磷酸>醋酸;
②醋酸与氢氧化钠反应生成CH3COONa为强碱弱酸盐,水解显碱性,所以其水溶液PH大于7,即CH3COO-+H2O?CH3COOH+OH-,故答案为:CH3COO-+H2O?CH3COOH+OH-;
③NaOH滴定磷酸时,消耗NaOH的量多,氢氧化钠的用量超过了碱式滴定管的最大体积读数,故答案为:不可行;中和后生成的醋酸钠水解使溶液显碱性.
点评 本题考查了中和滴定实验,以及弱酸的电离,盐类的水解,难度中等,要注意滴定管的选择.

练习册系列答案
相关题目
3.表是部分元素在周期表的位置,表中列有①~⑩中元素,用元素符号或化学式填空回答
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为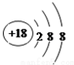
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)写出⑤的最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.则HXR的相对分子量为34;HXR的化学式为H2S.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)写出⑤的最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.则HXR的相对分子量为34;HXR的化学式为H2S.
20.下列关于物质分类的说法正确的是( )
| A. | CO2、NO2均为酸性氧化物 | B. | 石英、水玻璃均为纯净物 | ||
| C. | NaCl、BaSO4均为强电解质 | D. | 烧碱、纯碱均为碱 |
17.常温下,向等物质的量浓度的两种一元酸的钠盐溶液中,分别通入少量的二氧化碳气体,发生如下反应:NaA+CO2+H2O═NaHCO3+HA;2NaB+CO2+H2O═Na2CO3+2HB;则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是( )
| A. | HA较强 | B. | HB较强 | C. | 两者一样 | D. | 无法比较 |
4.下列离子方程式书写正确的是( )
| A. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2 Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| B. | 向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 向磷酸二氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3•H2O | |
| D. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O |
1.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应
②分析数据可知:人类不适合大规模模拟大气固氮原因K值小,正向进行的程度小(或转化率低),不适合大规模生产
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适
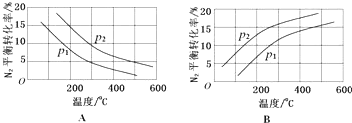
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.
(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮原因K值小,正向进行的程度小(或转化率低),不适合大规模生产
③从平衡角度考虑.工业固氮应该选择常温条件,但实际工业产生却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.

(3)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1.
2.X、Y、Z、W、Q是五种原子序数依次增大的短周期元素,除Z外的另外四种元素在周期表中的位置如图所示,其中Y、W、Q的最高价氧化物对应的水化物与Z的最高价氧化物对应的水化物间均能发生反应,下列说法中正确的是( )
| X | Y | ||
| W | Q |
| A. | 简单离子半径大小关系为:W>Z>Y | |
| B. | 核外最外层电子数:Q>Y>X>W>Z | |
| C. | X与氢元素形成的化合物中,只含极性键 | |
| D. | 常见单质的熔沸点:X>W>Z |
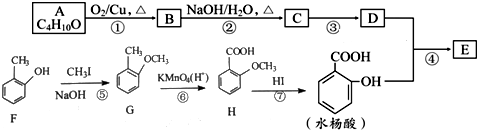
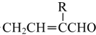
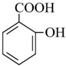 →
→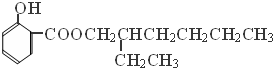 +H2O;
+H2O;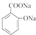
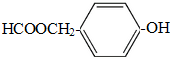 (写结构简式).
(写结构简式).