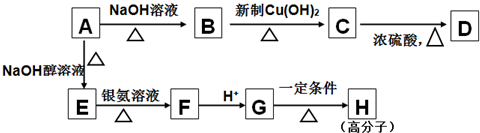
题目内容
①Zn+2HCl═ZnCl2+H2
②CuO+2HCl═CuCl2+H2O
③MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
④2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
试从氧化还原反应的角度回答下列问题.
(1)HCl在反应中作氧化剂的是 ;(填反应序号)
(2)HCl既作还原剂又表现了酸性的是 ;(填反应序号)
(3)反应③中氧化剂和还原剂的物质的量之比为 ;当有35.5g生成时,转移电子数为 ;
(4)根据反应③和④比较和的氧化性,比的氧化性 (“强“或“弱“);
(5)用双线桥标出反应④中转移的方向和数目.
②CuO+2HCl═CuCl2+H2O
③MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O
④2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
试从氧化还原反应的角度回答下列问题.
(1)HCl在反应中作氧化剂的是
(2)HCl既作还原剂又表现了酸性的是
(3)反应③中氧化剂和还原剂的物质的量之比为
(4)根据反应③和④比较和的氧化性,比的氧化性
(5)用双线桥标出反应④中转移的方向和数目.
考点:氧化还原反应,氧化还原反应的电子转移数目计算
专题:
分析:(1)分析各个反应中元素化合价变化,依据所含元素化合价升高的为还原剂,所含元素化合价降低的为氧化剂判断;
(2)依据氯化氢在反应中化合价的变化及得到的产物分析解答;
(3)MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O,二氧化锰中锰元素化合价降低,做氧化剂,4mol氯化氢中只有2mol氯化氢中化合价升高,做还原剂,生成1mol氯气转移2mol电子;
(4)依据二氧化锰、高锰酸钾氧化浓盐酸的条件判断;
(5)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e-.
(2)依据氯化氢在反应中化合价的变化及得到的产物分析解答;
(3)MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O,二氧化锰中锰元素化合价降低,做氧化剂,4mol氯化氢中只有2mol氯化氢中化合价升高,做还原剂,生成1mol氯气转移2mol电子;
(4)依据二氧化锰、高锰酸钾氧化浓盐酸的条件判断;
(5)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e-.
解答:
解:(1)①Zn+2HCl═ZnCl2+H2↑,反应中氯化氢氢元素化合价由+1→0,所以氯化氢做氧化剂,氯化氢表现酸性和氧化性;
②CuO+2HCl═CuCl2+H2O,反应中无化合价的变化,为非氧化还原反应,氯化氢表现酸性;
③MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O,反应中4mol氯化氢中只有2mol氯化氢中氯元素化合价升高,做还原剂,表现还原性,2mol氯化氢化合价不变,表现酸性;
④2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中16mol氯化氢中只有10mol氯化氢中氯元素化合价升高,做还原剂,表现还原性,6mol氯化氢化合价不变,表现酸性;
故答案为:①;
(2)③④中氯化氢在反应中,部分化合价升高做还原剂,部分氯化氢化合价不变,与金属阳离子生成盐,表现酸性,
故答案为:③④;
(3)③MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O,二氧化锰中锰元素化合价降低,做氧化剂,4mol氯化氢中只有2mol氯化氢中化合价升高,做还原剂,所以氧化剂与还原剂物质的量之比1:2;
依据方程式可知,生成1mol氯气转移2mol电子,35.5g氯气的物质的量=
=0.5mol,转移电子数=0.5mol×2=1mol;
故答案为:1:2;1mol;
(4)二氧化锰氧化浓盐酸需要在加热条件下,高锰酸钾氧化浓盐酸在常温下,所以高锰酸钾的氧化性强于二氧化锰;
故答案为:高锰酸钾强于二氧化锰;
(5)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e-,用双线桥标出电子的转移方向和数目为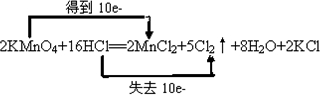 ;
;
故答案为: .
.
②CuO+2HCl═CuCl2+H2O,反应中无化合价的变化,为非氧化还原反应,氯化氢表现酸性;
③MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O,反应中4mol氯化氢中只有2mol氯化氢中氯元素化合价升高,做还原剂,表现还原性,2mol氯化氢化合价不变,表现酸性;
④2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,反应中16mol氯化氢中只有10mol氯化氢中氯元素化合价升高,做还原剂,表现还原性,6mol氯化氢化合价不变,表现酸性;
故答案为:①;
(2)③④中氯化氢在反应中,部分化合价升高做还原剂,部分氯化氢化合价不变,与金属阳离子生成盐,表现酸性,
故答案为:③④;
(3)③MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O,二氧化锰中锰元素化合价降低,做氧化剂,4mol氯化氢中只有2mol氯化氢中化合价升高,做还原剂,所以氧化剂与还原剂物质的量之比1:2;
依据方程式可知,生成1mol氯气转移2mol电子,35.5g氯气的物质的量=
| 35.5g |
| 71g/mol |
故答案为:1:2;1mol;
(4)二氧化锰氧化浓盐酸需要在加热条件下,高锰酸钾氧化浓盐酸在常温下,所以高锰酸钾的氧化性强于二氧化锰;
故答案为:高锰酸钾强于二氧化锰;
(5)2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,Mn元素的化合价降低,Cl元素的化合价升高,该反应转移10e-,用双线桥标出电子的转移方向和数目为
 ;
;故答案为:
 .
.
点评:本题考查了氧化还原反应的判断、概念及表示方法,把握反应中元素的化合价变化为解答的关键,侧重电子的转移、氧化剂和还原剂的判断的考查,注意从化合价角度分析,难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案
相关题目
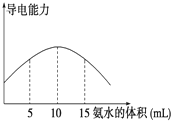 电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )| A、0.5% | B、1.5% |
| C、0.1% | D、1% |
下列说法正确的是( )
| A、分子晶体中一定不含离子键,但一定存在共价键 |
| B、金属与非金属元素形成的化合物一定是离子化合物 |
| C、NCl3分子中所有的原子均为8电子稳定结构 |
| D、NaHSO4晶体中阴、阳离子的个数比是1:2 |
下列说法正确的是( )
| A、摩尔是用来衡量微观粒子多少的一种物理量 |
| B、在一定的温度和压强下,各种气体的摩尔体积相等 |
| C、阿伏加德罗常数的数值是0.012 kg碳所含的原子个数 |
| D、若气体摩尔体积为22.4 L?mol-1,则所处条件为标准状况 |
短周期元素W、X、Y、Z的原子序数依次增大,下列相关比较错误的是( )
| A、稳定性:H2X<H2Z |
| B、酸性:H2YO3<HZO4 |
| C、还原性:W-<Z2- |
| D、半径:Y3+<Z2- |
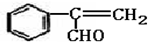 ,A及有机物的关系为:
,A及有机物的关系为: