题目内容
25℃1mL H2O中所含OH-数为10-18 NA. .(判断对错)
考点:物质的量的相关计算
专题:
分析:25℃时,Kw=10-14,c(H+)=c(OH-)=10-7mol/L,依据n=CV计算氢氧根离子的个数.
解答:
解:25℃时,Kw=10-14,c(H+)=c(OH-)=10-7mol/L,N(OH-)=10-7mol/L×1×10-3L×NA=10-10NA,故错误.
故答案为:错误.
故答案为:错误.
点评:本题考查了水的电离平衡,明确水的离子积常数及电离平衡是解题关键.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
将10mL N2和H2的混合气体在催化剂作用下,500℃左右发生下列可逆反应左右发生下列可逆反应:N2(g)+3H2(g)?2NH3(g),已知反应达到平衡后在相同条件下混合气体体积变为6mL,则在原混合气体中,N2和H2的物质的量之比可能是( )
| A、2:3 | B、1:3 |
| C、1:4 | D、1:7 |
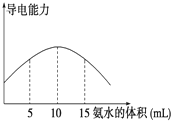 电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )| A、0.5% | B、1.5% |
| C、0.1% | D、1% |
重金属离子具有毒性.实验室中有甲、乙两种重金属离子的废液,甲废液经化验呈碱性,主要有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低.则乙废液中可能含有的离子是( )
| A、Cu2+和SO42- |
| B、Cu2+和Cl- |
| C、K+和SO42- |
| D、Ag+和NO3- |
下列说法正确的是( )
| A、摩尔是用来衡量微观粒子多少的一种物理量 |
| B、在一定的温度和压强下,各种气体的摩尔体积相等 |
| C、阿伏加德罗常数的数值是0.012 kg碳所含的原子个数 |
| D、若气体摩尔体积为22.4 L?mol-1,则所处条件为标准状况 |
当光束通过下列分散系时,能产生丁达尔现象的是( )
| A、Fe(OH)3乳浊液 |
| B、氯化钠溶液 |
| C、盐酸 |
| D、牛奶 |
 ③能与水在一定条件下反应生成C
③能与水在一定条件下反应生成C

