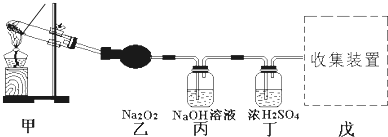
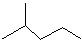
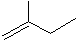
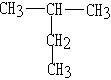
题目内容
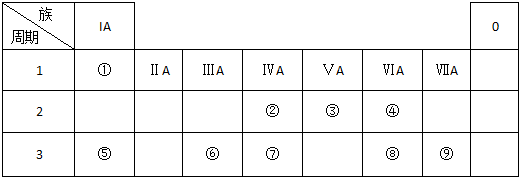
如表是元素周期表的一部分,回答下列有关问题:

(1)写出下列元素符号:① ,⑥ ,⑦ .
(2)在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 .(写元素符号))
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 .(写化学式)
(4)在③与④中,化学性质较活泼的是 ,怎样用化学实验证明:答: 在⑧与⑦中,化学性质较活泼的是 ,用化学方程式证明?答: .

(1)写出下列元素符号:①
(2)在这些元素中,最活泼的金属元素是
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是
(4)在③与④中,化学性质较活泼的是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:(1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑾为Ca、⑿为Br;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,稀有气体化学性质最不活泼;
(3)最高价氧化物对应水化物中,酸性最强的是高氯酸,上述元素中K的金属性最强,故氢氧化钾的碱性最强,氢氧化铝属于两性氢氧化物;
(4)同周期自左而右金属性减弱,可以利用金属与水反应的剧烈程度证明;
同周期自左而右非金属性最强,可以利用单质之间的相互置换进行验证.
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,稀有气体化学性质最不活泼;
(3)最高价氧化物对应水化物中,酸性最强的是高氯酸,上述元素中K的金属性最强,故氢氧化钾的碱性最强,氢氧化铝属于两性氢氧化物;
(4)同周期自左而右金属性减弱,可以利用金属与水反应的剧烈程度证明;
同周期自左而右非金属性最强,可以利用单质之间的相互置换进行验证.
解答:
解:(1)由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、⑾为Ca、⑿为Br,故答案为:N;Si;S;
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中K的金属性最强,F的非金属性最强,稀有气体Ar的化学性质最不活泼,故答案为:K;F;Ar;
(3)最高价氧化物对应水化物中,酸性最强的是HClO4,上述元素中K的金属性最强,故KOH的碱性最强,Al(OH)3属于两性氢氧化物,故答案为:HClO4;KOH;Al(OH)3;
(4)同周期自左而右金属性减弱,故金属性Na>Mg,可以利用金属与水反应的剧烈程度证明,Na与冷水剧烈反应,Mg与冷水发生缓慢反应,;
同周期自左而右非金属性增强,故非金属性Cl>S,可以利用单质之间的相互置换进行验证,相应方程式为Na2S+Cl2=S↓+2NaCl,
故答案为:Na;Na与冷水剧烈反应,Mg与冷水发生缓慢反应;Cl;Na2S+Cl2=S↓+2NaCl.
(2)同周期自左而右金属性减弱、非金属性增强,同主族自上而下金属性增强、非金属性减弱,故上述元素中K的金属性最强,F的非金属性最强,稀有气体Ar的化学性质最不活泼,故答案为:K;F;Ar;
(3)最高价氧化物对应水化物中,酸性最强的是HClO4,上述元素中K的金属性最强,故KOH的碱性最强,Al(OH)3属于两性氢氧化物,故答案为:HClO4;KOH;Al(OH)3;
(4)同周期自左而右金属性减弱,故金属性Na>Mg,可以利用金属与水反应的剧烈程度证明,Na与冷水剧烈反应,Mg与冷水发生缓慢反应,;
同周期自左而右非金属性增强,故非金属性Cl>S,可以利用单质之间的相互置换进行验证,相应方程式为Na2S+Cl2=S↓+2NaCl,
故答案为:Na;Na与冷水剧烈反应,Mg与冷水发生缓慢反应;Cl;Na2S+Cl2=S↓+2NaCl.
点评:本题考查元素周期表与元素周期律,侧重对元素周期律的考查,注意理解掌握金属性、非金属性强弱比较及实验事实.

练习册系列答案
相关题目
下列说法正确的是( )
| A、“纳米材料”是指微粒直径为几纳米到几十纳米的材料,故纳米材料是胶体 |
| B、将饱和FeCl3溶液滴入NaOH浓溶液中,可制得Fe(OH)3胶体 |
| C、分散剂一定是液体 |
| D、用丁达尔效应可区分胶体和溶液 |
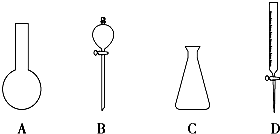 根据常见仪器的特点及使用注意事项回答下列问题.
根据常见仪器的特点及使用注意事项回答下列问题.