题目内容
19.检验某溶液含有氯离子的试剂合理的是( )| A. | AgNO3溶液 | B. | KI淀粉试纸 | ||
| C. | 稀HNO3和AgNO3溶液 | D. | NaBr溶液和CCl4 |
分析 检验某溶液含有氯离子,先加硝酸排除干扰离子,再加硝酸银观察是否生成白色沉淀,以此来解答.
解答 解:A.硝酸银与氯离子、碳酸根离子等均反应生成白色沉淀,不能检验,故A不选;
B.氯离子与KI不反应,不能检验,故B不选;
C.先加硝酸排除干扰离子,再加硝酸银生成白色沉淀,可检验氯离子,故C选;
D.氯离子与NaBr不反应,不能检验,故D不选;
故选C.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象与结论为解答的关键,侧重分析与实验能力的考查,注意排除干扰离子的影响,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 能与铝反应放出氢气的溶液中:K+、SO42-、NO3-、NH4+ | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
10.如图是进行电化学实验的两个装置,下列有关说法正确的是( )

| A. | 甲装置中有沉淀生成,乙装置中Mg电极上有气泡生成 | |
| B. | 反应后,甲装置中溶液的质量增大,乙装置中溶液的质量减小 | |
| C. | 电极反应式:甲中阳极Fe-2e-=Fe2+,乙中负极Mg-2e-=Mg2+ | |
| D. | 反应后甲中溶液的pH减小,乙中溶液的pH增大 |
14.臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:3O2$\frac{\underline{\;放电\;}}{\;}$2O3.
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为35.6 g•mol-1(保留一位小数).
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为3 L.
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为50%.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠,通过计算,分析和比较上表3组数据,给出结论.
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为35.6 g•mol-1(保留一位小数).
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为3 L.
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为50%.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
4.下列化学用语正确的是( )
| A. | 126C是指质子数是6、中子数是12的碳原子 | |
| B. | 醋酸的电离方程式为CH3COOH=CH3COO-+H+ | |
| C. | 钠原子的结构示意图为: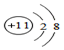 | |
| D. | 4020Ca和4220Ca 互为同位素 |
11.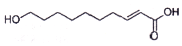 王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )
王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )
 王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )
王浆酸是蜂王浆中特有的一种不饱和脂肪酸,在自然界中只有蜂王浆中才含有这种物质.其结构简式如图:下列有关干浆酸的结构与性质的说法正确的是( )| A. | 含有两种官能团 | |
| B. | 与足里NaOH反应生成Cl0H18O3Na2 | |
| C. | 能发生加成反应,氧化反应、取代反应、加聚反应 | |
| D. | 能使Br/CCl4溶液、酸性KMnO4溶液褪色,褪色原理相同 |
9.下列化学反应的离子方程式正确的是( )
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | Cl2通入NaOH溶液中:Cl2+OH-═Cl-+ClO-+H2O | |
| C. | 二氧化氮与水反应:3NO2+H2O═2H++2NO3-+NO | |
| D. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O |
