题目内容
7.下列有关叙述正确的是( )| A. | 同种元素的原子均具有相同的质子数和中子数 | |
| B. | 不同元素的原子构成的分子只含有极性键 | |
| C. | 第三周期非金属元素气态氢化物的稳定性越强,对应元素的最高价含氧酸的酸性越强 | |
| D. | 第ⅠA族和第ⅦA族元素从上到下随原子序数递增,单质的沸点均逐渐升高 |
分析 A.H的质子数为1,中子数可能为0、1、2;
B.H-O-O-H中含极性键和O-O非极性键;
C.非金属性越强,对应氢化物越稳定、对应最高价含氧酸的酸性越强;
D.第ⅠA族从上到下随原子序数递增,单质的沸点均逐渐降低.
解答 解:A.H的质子数为1,中子数可能为0、1、2,则原子中的质子数与中子数不一定相同,故A错误;
B.H-O-O-H中含极性键和O-O非极性键,则不同元素的原子构成的分子不一定只含有极性键,故B错误;
C.第三周期从左向右非金属增强,元素非金属性越强,对应氢化物越稳定、对应最高价含氧酸的酸性越强,故C正确;
D.第ⅠA族从上到下随原子序数递增,单质的沸点逐渐降低,而第ⅦA族元素从上到下随原子序数递增,单质的沸点逐渐升高,与单质中作用力有关,故D错误;
故选C.
点评 本题考查元素周期表及化学键等,为高频考点,把握元素的位置、性质、化学键判断为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
17.下列关于化学基本原理和基本概念的几点认识中正确的是( )
| A. | 胶体区别于其他分散系的本质特征是丁达尔效应 | |
| B. | H216O、D216O、H218O、D218O互为同素异形体 | |
| C. | 明矾和漂白粉常用于自来水的净化或杀菌消毒,但两者的作用原理不同 | |
| D. | 由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 |
15.下列各种变化中,不属于化学变化的是( )
| A. | 向鸡蛋溶液中滴入饱和硫酸钠溶液,析出白色沉淀 | |
| B. | 加热胆矾得到白色的无水硫酸铜粉末 | |
| C. | 向沸水中滴入饱和氯化铁溶液,制取氢氧化铁胶体 | |
| D. | 向鸡蛋白溶液中滴入硝酸铅溶液,析出白色沉淀 |
2.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+ K+ CO32- Cl- | B. | Na+ Cu2+ SO42- NO3- | ||
| C. | K+ Na+ SO42- Cl- | D. | Ba2+ HCO3- NO3- K+ |
12.下列物质中能与烧碱溶液发生氧化还原反应的是( )
| A. | CuSO4 | B. | CO2 | C. | NH4Cl | D. | Al |
19.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 常温常压下,11.2L氮气所含的原子数为NA | |
| B. | 1mol硫与铁充分反应转移的电子数为2NA | |
| C. | 常温常压下,48gSO3含有的分子数为3NA | |
| D. | 常温常压下,1molNO2气体与水反应生成NA个NO3-离子 |
17.下列物质能够导电且属于电解质的是( )
| A. | 稀盐酸 | B. | 蔗糖 | C. | 硝酸钾晶体 | D. | 熔融氯化钠 |
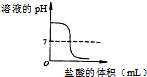

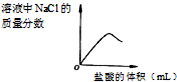
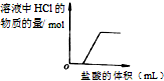
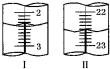 有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,甲、乙两位同学分别设计了如下实验方案:
有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,甲、乙两位同学分别设计了如下实验方案: