题目内容
下列物质的水溶液呈碱性的是( )
| A、K2SO4 |
| B、NH4Cl |
| C、Na2CO3 |
| D、H2SO3 |
考点:盐类水解的原理
专题:
分析:溶液呈碱性,应为强碱弱酸盐或碱溶液,以此解答该题.
解答:
解:A.硫酸钾为强酸强碱盐,溶液呈中性,故A错误;
B.氯化铵为强酸弱碱盐,溶液呈酸性,故B错误;
C.碳酸钠为强碱弱酸盐,溶液呈碱性,故C正确;
D.H2SO3为酸,溶液呈酸性,故D错误.
故选C.
B.氯化铵为强酸弱碱盐,溶液呈酸性,故B错误;
C.碳酸钠为强碱弱酸盐,溶液呈碱性,故C正确;
D.H2SO3为酸,溶液呈酸性,故D错误.
故选C.
点评:本题考查盐类水解的应用,题目难度不大,注意把握盐类水解的规律以及水解原理,把握相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列叙述不正确的是( )
| A、虽然石墨有较好的导电性,但它不属于电解质 |
| B、CaCO3、BaSO4都难溶于水,但它们都是电解质 |
| C、实验测定液态HCl、固体KNO3均不能导电,所以HCl、KNO3均是非电解质 |
| D、酒精(纯净物)在水溶液和熔融状态下均不能导电,所以酒精属于非电解质 |
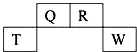 如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )
如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )| A、气态氢化物稳定性:R>Q |
| B、Q与W可形成直线型分子QW2 |
| C、同主族气态氢化物中R的氢化物最稳定,因其分子间存在氢键 |
| D、原子半径:T>W,简单离子半径:T<W |
下列说法正确的是( )
| A、难溶电解质作比较时,Ksp小的,溶解度一定小 |
| B、Ksp大小取决于难溶电解质的量,所以离子浓度改变时,沉淀平衡会发生移动 |
| C、所谓沉淀完全就是用沉淀剂将溶液中某一离子完全除去 |
| D、温度一定,当溶液中Ag+ 和Cl-浓度的乘积等于Ksp时,溶液为AgCl的饱和溶液 |
下列溶液中各微粒的浓度关系一定正确的是( )
| A、25°C时,pH=10的CH3COONa溶液与pH=10的氨水中,c(OH-)之此为1:1 |
| B、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-) |
| C、浓度相同的①CH3COONa②NaNO3③Na2CO3④NaOH四种溶液,pH的大小顺序是:④>③>②>① |
| D、只含NH4+、Cl-、H+、OH-四种离子的酸性溶液中,一定存在:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
 乙醇的催化氧化,看右图答出实验现象.
乙醇的催化氧化,看右图答出实验现象.