题目内容
向少量FeCl3溶液中滴入KSCN溶液,发生反应:FeCl3+3KSCN?Fe(SCN)3+3KCl.欲使试管内溶液红色变浅,下列措施合理的是( )
①加Fe(SCN)3 ②加NaOH固体 ③加Zn粉 ④加KCl固体.
①加Fe(SCN)3 ②加NaOH固体 ③加Zn粉 ④加KCl固体.
| A、②③ | B、②④ | C、①② | D、①④ |
考点:化学平衡的影响因素
专题:
分析:①加入Fe(SCN)3,增大生成物浓度,平衡向逆反应方向移动;
②Fe3+与OH-生成Fe(OH)3沉淀,导致Fe3+浓度降低;
③加入一定量的Zn粉,Zn粉与铁离子反应,溶液中Fe3+浓度降低;
④根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变;
②Fe3+与OH-生成Fe(OH)3沉淀,导致Fe3+浓度降低;
③加入一定量的Zn粉,Zn粉与铁离子反应,溶液中Fe3+浓度降低;
④根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变;
解答:
解:①加入Fe(SCN)3,增大生成物浓度,平衡向逆反应方向移动,但试管内溶液颜色变深,故①错误;
②Fe3+与OH-生成Fe(OH)3沉淀,导致Fe3+浓度降低,平衡向逆反应方向移动,试管内溶液颜色变浅,故②正确;
③加入一定量的Zn粉,Zn粉与铁离子反应,溶液中Fe3+浓度降低,平衡向逆反应方向移动,试管内溶液颜色变浅,故③正确;
④根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,平衡不移动,故④错误;
故选A.
②Fe3+与OH-生成Fe(OH)3沉淀,导致Fe3+浓度降低,平衡向逆反应方向移动,试管内溶液颜色变浅,故②正确;
③加入一定量的Zn粉,Zn粉与铁离子反应,溶液中Fe3+浓度降低,平衡向逆反应方向移动,试管内溶液颜色变浅,故③正确;
④根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,平衡不移动,故④错误;
故选A.
点评:本题考查学生对平衡移动原理的理解,比较基础,注意①中平衡移动是减弱而不是抵消.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
 已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是:( )
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是:( )| 选项 | A | B | C | D |
| X | C | Fe | Ca(OH)2溶液 | AlCl3 |
| W | O2 | HNO3 | CO2 | NH3?H2O |
| A、A | B、B | C、C | D、D |
下列热化学方程式或离子方程式不正确的是( )
| A、向1mol?L-1明矾溶液50mL中滴入数滴0.1mol?L-1Ba(OH)2溶液Al3++2 SO42-+2Ba2++3OH-=Al(OH)3↓+2BaSO4↓ |
| B、将1mol?L-1 NaAlO2溶液和1.5mol?L-1的HCl溶液等体积互相均匀混合6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ |
| C、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1 |
| D、将少量CO2气体通入NaClO溶液中:CO2+H2O+2ClO-=CO32-+2HClO |
反应SiCl4+2H2
Si(纯)+4HCl可用于工业制取纯硅.该反应属于( )
| ||
| A、化合反应 | B、复分解反应 |
| C、置换反应 | D、分解反应 |
下列说法中,正确的是( )
| A、物质的量就是物质的质量 | ||||
| B、摩尔是表示物质质量的单位 | ||||
| C、水的摩尔质量就是它的相对分子质量 | ||||
D、在相同温度和压强下,2H2+O2
|
下列叙述不正确的是( )
| A、虽然石墨有较好的导电性,但它不属于电解质 |
| B、CaCO3、BaSO4都难溶于水,但它们都是电解质 |
| C、实验测定液态HCl、固体KNO3均不能导电,所以HCl、KNO3均是非电解质 |
| D、酒精(纯净物)在水溶液和熔融状态下均不能导电,所以酒精属于非电解质 |
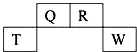 如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )
如图为元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )| A、气态氢化物稳定性:R>Q |
| B、Q与W可形成直线型分子QW2 |
| C、同主族气态氢化物中R的氢化物最稳定,因其分子间存在氢键 |
| D、原子半径:T>W,简单离子半径:T<W |