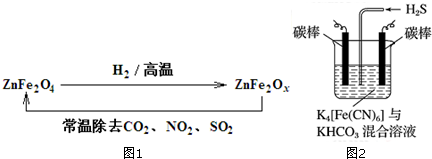
题目内容
8.强酸与强碱的稀溶液发生中和反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1分别向1L 0.5mol•L-1的NaOH溶液中加入:①稀醋酸,②浓硫酸,③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,它们的关系正确的是( )
| A. | △H1>△H2>△H3 | B. | △H2<△H1<△H3 | C. | △H1=△H2=△H3 | D. | △H1>△H3>△H2 |
分析 由信息可知,稀的强酸与强碱生成1molH2O(l)放出的热量为57.3kJ,结合弱电解质的电离吸热、浓硫酸溶于水放热来解答.
解答 解:强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)十OH-(aq)=H2O△H=-57.3kJ/mol,分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸、②浓H2SO4、③稀硝酸,因醋酸的电离吸热、浓硫酸溶于水放热,则恰好完全反应时的放出的热量为②>③>①,焓变为负值,所以△H1>△H3>△H2,
故选D.
点评 本题考查反应热与焓变,为高频考点,把握中和反应的实质、弱电解质的电离、浓硫酸的稀释为解答的关键,侧重分析与应用能力的考查,注意中和反应中焓变为负值,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案
相关题目
20.设NA为阿伏伽德罗常数,下列说法中正确的是( )
| A. | 1molNa2O2固体中含阴离子个数为2NA | |
| B. | 1molSiO2中含Si-O的数目为2NA | |
| C. | 标准状况下,22.4L乙炔中含π键数为2NA | |
| D. | 1molNaHCO3晶体中阳离子数为2NA |
1.有A、B、C、D四种金属,将A、B用导线连接后浸在稀硫酸中,A上放出氢气,B逐渐溶解生成B2+;在含 A2+和C2+的混合溶液中加入铁,铁棒先析出C;将D放入B2+的硝酸盐溶液中,D表面有B析出.这四种金属阳离子的氧化性由强到弱的顺序是( )
| A. | D2+>B2+>A2+>C2+ | B. | A2+>B2+>C2+>D2+ | C. | C2+>A2+>B2+>D2+ | D. | A2+>C2+>D2+>B2+ |
18.下列物质性质与用途对应关系正确的是( )
| A. | Na2O2具有强的氧化性,可以做供氧剂 | |
| B. | Na2CO3溶液呈碱性,可以清除餐具表面的油污 | |
| C. | 晶体硅熔点高、硬度大,可用于制作半导体材料 | |
| D. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 |
13.某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,产生无色无味无毒的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀的物质的量与加入NaOH的物质的量之间的关系如右图所示.则下列说法正确的是( )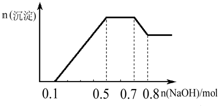

| A. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| B. | 溶液中一定不含CO32-,一定含有SO42-和NO3- | |
| C. | 溶液中n(NH4+)=0.2 mol | |
| D. | 三种离子的物质的量之比n(H+):n(Al3+):n(Mg2+)=1:1:1 |
18.下列物质中,既含有非极性共价键又含有离子键的是( )
| A. | Na2O2 | B. | NaCl | C. | NaOH | D. | Br2 |