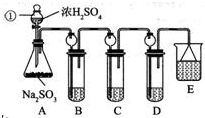
题目内容
6.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 一定条件下6.4g S02与足量氧气反应生成S03,转移电子数小于0.2 NA | |
| C. | lmol羟基(一OH)与17gNH3所含电子数都为NA | |
| D. | 适量铜粉溶解于1 L 0.5mol/L稀硝酸中,当生成2.24 L NO时,溶液中氮原子数0.4 NA |
分析 A.根据阳极Cu-2e═Cu2+,电解精炼铜时阳极为粗铜来分析;
B.二氧化硫与氧气反应为可逆反应,可逆反应不能完全进行到底;
C.1个羟基含有9个电子,1个氨气分子含有10个电子;
D.根据3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O及气体是否在标准状况下来分析.
解答 解:A.由Cu-2e═Cu2+,每转移NA个电子时,阳极溶解铜的质量为0.5mol×64g/mol=32g,但阳极材料为粗铜,则阳极溶解铜的质量小于32g,故A错误;
B.一定条件下6.4g S02与足量氧气反应生成S03,二氧化硫不能完全转化为三氧化硫,所以转移电子数小于0.2 NA,故B正确;
C.lmol羟基(一OH)含电子数都为9NA,与17gNH3所含电子数为10NA,故C错误;
D.若为标准状况,由3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O可计算出溶液中氮原子,但不知是否为标准状况,则无法利用NO的体积来计算其物质的量,故D错误;
故选B.
点评 本题考查有关物质的量及阿伏伽德罗常数的计算,明确电解法精炼铜原理、可逆反应特点、气体摩尔体积使用条件和对象是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列实验操作、实验现象和结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向AgNO3溶液中加入过量氨水 | 由白色沉淀生成 | Ag+与NH3•H2O不能共存 |
| B | 向2ml2%的CuSO4溶液中加入0.5mol/L的NaOH溶液,震荡后低价几滴M溶液,加热 | 未出现砖红的沉淀 | M不属于醛类物质 |
| C | 向NaAlO2溶液中滴加饱和NaHCO3溶液 | 由白色沉淀生成 | 验证两者都发生了水解反应,且相互促进 |
| D | 向草酸溶液中低价几滴紫色酸性KmnO4溶液,震荡 | 溶液紫色褪去 | 草酸具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
14.下列实验操作或方法中,不合理的是( )
| A. | 用钥匙取用少量二氧化锰粉末 | |
| B. | 向燃着的酒精灯中直接添加酒精 | |
| C. | 实验室加热高猛酸钾制氧气的装置制取氨气 | |
| D. | 实验室将少量金属钠保存在煤油中 |
1.一种新药物结构如图所示,下列有关说法正确的是( )


| A. | 该化合物的分子式为C17H17N2O6 | |
| B. | 该化合物的分子中含有三种不同的官能团 | |
| C. | 该化合物的不饱和度为10 | |
| D. | 该化合物能发生水解反应、聚合反应、取代反应、消去反应 |
11.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,11.2 L氧气含有的原子数目为NA | |
| B. | 锌从盐酸中置换出1 mol H2,转移的电子数目为NA | |
| C. | 4.4 g 二氧化碳含有的分子数目为0.1 NA | |
| D. | 1 mol/L CaCl2溶液中含有的氯离子数目为2NA |
18.肉桂酸甲酯(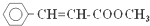 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )
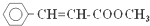 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.有关肉桂酸甲酯的叙述中,不正确的是( )| A. | 能与溴的四氯化碳溶液发生加成反应 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 在碱性条件下能发生水解反应 | |
| D. | 不可能发生加聚反应 |
15.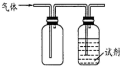 用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是
( )
 用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做相应实验,其中收集方法及所加试剂、现象、结论均正确的是| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | X | 酸性高锰酸钾溶液 | 溶液褪色 | X一定SO2 |
| B | NH3 | 酚酞试液 | 溶液变为红色 | 氨水呈碱性 |
| C | NO2 | KI-淀粉溶液 | 溶液变为蓝色 | NO2有还原性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
16.下列关于氧化钠和过氧化钠的叙述中,正确的是( )
| A. | 都属于碱性氧化物 | B. | 溶于水后所得溶液的成分相同 | ||
| C. | 阴、阳离子个数比不同 | D. | 氧元素的化合价相同 |