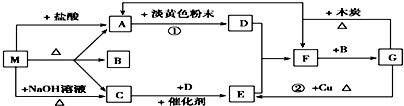
题目内容
12.(1)现有可逆反应.2NO2(g)═N2O4(g),△H<0,试根据图象判断t2、t3、t4时刻采取的措施.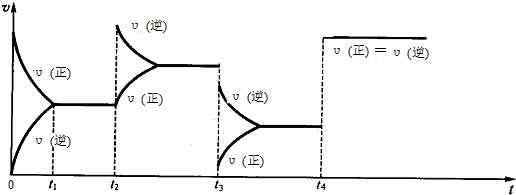
t2:增大生成物N2O4的浓度;t3:降低压强;t4:加入催化剂.
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如表数据:
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(3)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L.s).
(4)在80℃时该反应的平衡常数K值为0.54(保留2位小数).
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
(6)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867 kJ/mol.
分析 (1)t2时正反应速率瞬间不变,逆反应速率增大,然后逆反应速率逐渐减小,正反应速率逐渐增大,直至重新达到平衡,说明t2时加入了加入N2O4;
t3时正逆反应速率瞬间同时减小,且逆反应速率减小的幅度小于正反应速率,即v(正)<v(逆),平衡向着逆向移动,正反应为气体体积减小的放热反应,应是降低温度;
t4时刻正逆反应速率同时增大,且相等,改变的条件不影响化学平衡,则说明使用了催化剂;
(2)40s时转化的N2O4为0.2mol/L-0.1mol/L=0.1mol/L,NO2的产率等于N2O4的转化率;
(3)20s时,NO2浓度为0.12mol/L,则△c(N2O4)=$\frac{1}{2}$×0.12mol/L=0.06mol/L,20sN2O4的浓度=N2O4的起始浓度-△c(N2O4),根据v=$\frac{△c}{△t}$计算0~20s内N2O4的平均反应速率;
(4)平衡时NO2浓度为0.22mol/L,则c(N2O4)=0.2mol/L-$\frac{1}{2}$×0.22mol/L=0.09mol/L,再根据K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$计算平衡常数;
(5)K值越大,说明正反应进行的程度越大;
(6)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol
根据盖斯定律,(①+②)÷2可得:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g).
解答 解:(1)t2时正反应速率瞬间不变,逆反应速率增大,然后逆反应速率逐渐减小,正反应速率逐渐增大,直至重新达到平衡,说明t2时加入了加入N2O4;
t3时正逆反应速率瞬间同时减小,且逆反应速率减小的幅度小于正反应速率,即v(正)<v(逆),平衡向着逆向移动,正反应为气体体积减小的放热反应,应是降低温度;
t4时刻正逆反应速率同时增大,且相等,改变的条件不影响化学平衡,则说明使用了催化剂,
故答案为:增大生成物N2O4的浓度;降低压强;加入催化剂;
(2)40s时转化的N2O4为0.2mol/L-0.1mol/L=0.1mol/L,NO2的产率等于N2O4的转化率,则NO2的产率为$\frac{0.1mol/L}{0.2mol/L}$×100%=50%,
故答案为:50%;
(3)20s时,NO2浓度为0.12mol/L,则△c(N2O4)=$\frac{1}{2}$×0.12mol/L=0.06mol/L,20sN2O4的浓度=0.2mol/L-0.06mol/L=0.14mol/L,0~20s内N2O4的平均反应速率为$\frac{0.06mol/L}{20s}$=0.003mol/(L.s),
故答案为:0.14;0.003mol/(L.s);
(4)平衡时NO2浓度为0.22mol/L,则c(N2O4)=0.2mol/L-$\frac{1}{2}$×0.22mol/L=0.09mol/L,则平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$=$\frac{0.2{2}^{2}}{0.09}$=0.54,
故答案为:0.54;
(5)K值越大,说明正反应进行的程度越大,则N2O4的转化率越高、NO2的产量越大,N2O4与NO2的浓度之比越小,
故选:ABD;
(6)已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol
根据盖斯定律,(①+②)÷2可得:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867 kJ/mol,
故答案为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867 kJ/mol.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、反应速率与平衡常数、盖斯定律应用等,侧重考查学生读图提取信息能力与知识迁移运用能力,难度中等.

 阅读快车系列答案
阅读快车系列答案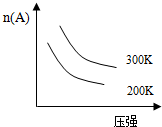
| A. | 3A(g)+B(g)?2C(g);△H<0 | B. | A(g)+3B(s)+2C(g)?3D(g);△H<0 | ||
| C. | C(s)+D(g)?A(g)+B(g)△H>0 | D. | 2C(g)?2A(g)+B(g)△H>0 |
| A. | 等于p% | B. | 大于p% | C. | 小于p% | D. | 无法判断 |
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| A. | 0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3) | |
| B. | 常温下,NH4Cl和NH3•H2O混合溶液的PH=7:c(NH4+ )=c(Cl-) | |
| C. | 向醋酸溶液中加入适量醋酸钠,得到的碱性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 常温下,向硝酸钾溶液中滴加稀盐酸得到的pH=5的混合溶液:c(K+)>c(NO3-) |
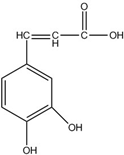
| A. | 分子式为C9H5O4 | |
| B. | 1mol该有机物最多可与3mol氢气发生加成反应 | |
| C. | 与溴水既能发生取代反应,又能发生加成反应 | |
| D. | 能与Na2CO3溶液反应,也能与NaHCO3溶液反应 |