题目内容
7.有下列六种物质的溶液:①氨水 ②NH4Cl ③NaHSO4 ④醋酸 ⑤CH3COONa ⑥NaHCO3①溶液呈酸性的是②③④;(将相应的序号填入空格,下同)
②溶液呈碱性的是①⑤⑥;
③能促进水电离的是②⑤⑥;
④能抑制水电离的是①③④.
分析 ①氨水溶液呈碱性;
②NH4Cl为强酸弱碱盐,其溶液呈酸性;
③NaHSO4为强酸强碱的酸式盐,其溶液呈酸性;
④醋酸溶液呈酸性;
⑤CH3COONa为强碱弱酸盐,醋酸根离子水解导致溶液呈碱性;
⑥NaHCO3中碳酸氢根离子水解程度大于电离程度,所以其溶液呈碱性;
酸与碱对水的电离起抑制作用,而盐的水解对水的电离起促进作用,由此分析解答.
解答 解:①氨水溶液呈碱性;
②NH4Cl为强酸弱碱盐,其溶液呈酸性;
③NaHSO4为强酸强碱的酸式盐,其溶液呈酸性;
④醋酸溶液呈酸性;
⑤CH3COONa为强碱弱酸盐,醋酸根离子水解导致溶液呈碱性;
⑥NaHCO3中碳酸氢根离子水解程度大于电离程度,所以其溶液呈碱性;
酸与碱对水的电离起抑制作用,而盐的水解对水的电离起促进作用,所以
①溶液呈酸性的是②③④;
②溶液呈碱性的是①⑤⑥;
③能促进水电离的是②⑤⑥;
④能抑制水电离的是①③④;故答案为:②③④;①⑤⑥;②⑤⑥;①③④.
点评 本题考查了弱电解质的电离及盐类水解,根据“谁强谁显性、谁弱谁水解、强强显中性”确定盐溶液酸碱性,从而确定溶液pH大小,题目难度不大.

练习册系列答案
相关题目
15.用甲烷和二氧化碳可以制备化工原料.
(1)一定温度下,向容积恒定为2L的密闭容器中通人3molCO2、3molCH4,发生如下反应:
CO2(g)+CH4 (g)?2CO (g)+2H2(g)
反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等.请回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/(L.min);
②此温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC;(填选项字母)
A.v正(CH4)=2v 逆(H2) B.容器内压强保持恒定不变
C.反应中断裂2mol C一H键同时消耗lmolH2 D.容器内混合气体的密度保持恒定不变
④已知:
则反应CO2(g)+CH4(g)?2CO (g)+2H2(g)△H=+248kJ/mol.
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度(写两点).
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图所示:
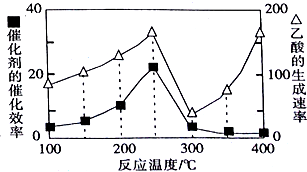
在250~400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,温度升高催化剂的催化效率降低,250~300℃之间催化剂为影响反应速率主要因素,乙酸的生成速率降低,而温度高于300℃后,温度是影响反应速率主要因素,乙酸的生成速率随温度升高而升高.
②250℃与400℃时乙酸的生成速率相近,请分析判断实际生产选择的最佳温度是250℃.
(1)一定温度下,向容积恒定为2L的密闭容器中通人3molCO2、3molCH4,发生如下反应:
CO2(g)+CH4 (g)?2CO (g)+2H2(g)
反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等.请回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/(L.min);
②此温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC;(填选项字母)
A.v正(CH4)=2v 逆(H2) B.容器内压强保持恒定不变
C.反应中断裂2mol C一H键同时消耗lmolH2 D.容器内混合气体的密度保持恒定不变
④已知:
| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度(写两点).
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图所示:

在250~400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,温度升高催化剂的催化效率降低,250~300℃之间催化剂为影响反应速率主要因素,乙酸的生成速率降低,而温度高于300℃后,温度是影响反应速率主要因素,乙酸的生成速率随温度升高而升高.
②250℃与400℃时乙酸的生成速率相近,请分析判断实际生产选择的最佳温度是250℃.
2.在一固定体积的密闭容器中,充入2mol CO2和1mol H2发生如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数与温度(T)的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$.
(2)若反应在830℃下达到平衡,则CO2气体的转化率为$\frac{1}{3}$.
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度升高(填“升高”、“降低”或“不能确定”).
(4)在830℃达平衡后在其容器中分别仅充入1mol CO2 和1molCO后,该反应的v正小于 v逆((填“大于”“小于”“等于”),平衡向逆方向移动.
| t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO).c({H}_{2}O)}{c(C{O}_{2}).c({H}_{2})}$.
(2)若反应在830℃下达到平衡,则CO2气体的转化率为$\frac{1}{3}$.
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度升高(填“升高”、“降低”或“不能确定”).
(4)在830℃达平衡后在其容器中分别仅充入1mol CO2 和1molCO后,该反应的v正小于 v逆((填“大于”“小于”“等于”),平衡向逆方向移动.
12.(1)现有可逆反应.2NO2(g)═N2O4(g),△H<0,试根据图象判断t2、t3、t4时刻采取的措施.
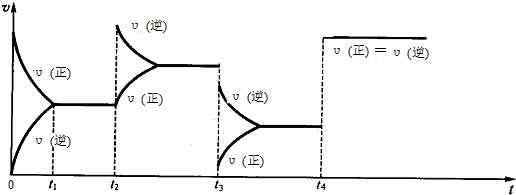
t2:增大生成物N2O4的浓度;t3:降低压强;t4:加入催化剂.
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如表数据:
(2)40s时,NO2的产率是50%.
(3)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L.s).
(4)在80℃时该反应的平衡常数K值为0.54(保留2位小数).
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
(6)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867 kJ/mol.

t2:增大生成物N2O4的浓度;t3:降低压强;t4:加入催化剂.
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如表数据:
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(3)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L.s).
(4)在80℃时该反应的平衡常数K值为0.54(保留2位小数).
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
(6)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867 kJ/mol.
16.某溶液X中可能大量存在K+、NH4+、Mg2+、Fe3+、Al3+、SiO32-、HCO3-、SO42-、Cl-中的若干种离子.某同学对该溶液进行了如图实验:下列判断不正确的是( )


| A. | Fe3+肯定不存在 | |
| B. | 无色气体甲不一定是纯净物 | |
| C. | K+、Mg2+、Al3+和SO42-一定存在于溶液X中 | |
| D. | 白色沉淀乙肯定不是Al(OH)3和H2SiO3的混合物 |
17. 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应:
 CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH2═CH2(g)+H2(g)
CH2═CH2(g)+H2(g)
(1)已知:
计算上述反应的△H=+124 kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{{a}^{2}}{(1-{a}^{2})}$p(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意如图:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果.
②控制反应温度为600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭 ④有利于CO2资源利用.
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH2═CH2(g)+H2(g)
CH2═CH2(g)+H2(g)(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{{a}^{2}}{(1-{a}^{2})}$p(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意如图:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果.
②控制反应温度为600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭 ④有利于CO2资源利用.