题目内容
3.如图所示,不能适用于下列可逆反应的是( )
| A. | 3A(g)+B(g)?2C(g);△H<0 | B. | A(g)+3B(s)+2C(g)?3D(g);△H<0 | ||
| C. | C(s)+D(g)?A(g)+B(g)△H>0 | D. | 2C(g)?2A(g)+B(g)△H>0 |
分析 由图可知,温度越高A的物质的量越大,说明升高温度平衡向生成A的方向移动,而压强越大A的物质的量越小,说明增大压强平衡向消耗A的方向移动,根据选项结合平衡移动原理分析.
解答 解:由图可知,温度越高A的物质的量越大,说明升高温度平衡向生成A的方向移动,而压强越大A的物质的量越小,说明增大压强平衡向消耗A的方向移动.
A.正反应为气体体积减小的放热反应,升高温度平衡逆向移动,A的物质的量增大,增大压强平衡正向移动,A的物质的量减小,与图象相符合,故A正确;
B.正反应为气体体积不变的放热反应,增大压强平衡不移动,A的物质的量不变,与图象不符合,故B错误;
C.正反应为气体体积增大的吸热反应,升高温度平衡正向移动,A的物质的量增大,增大压强平衡逆向移动,A的物质的量减小,与图象相符合,故C正确;
D.正反应为气体体积增大的吸热反应,升高温度平衡正向移动,A的物质的量增大,增大压强平衡逆向移动,A的物质的量减小,与图象相符合,故D正确,
故选:B.
点评 本题考查化学平衡影响因素、化学平衡图象,注意利用定一议二分析温度、压强对平衡移动的影响,注意对平衡移动原理的理解掌握.

练习册系列答案
相关题目
17.以0.10mol/L的氢氧化钠溶液滴定某一元酸HA的滴定曲线如图所示.下列表述正确的是( )


| A. | 此实验可以选用甲基橙作指示剂 | |
| B. | 该酸HA的浓度约为1×10-4mol/L | |
| C. | 当NaOH体积为9 mL时,恰好完全中和反应 | |
| D. | 达到滴定终点时,溶液中c(Na+)>c (A-) |
15.下列说法中,正确的是( )
| A. | 甲醛、乙醛、丙醛通常情况下都是液体 | |
| B. | 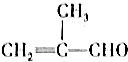 是乙醛的同系物 是乙醛的同系物 | |
| C. | 可用浓盐酸洗去银镜反应实验生成的银镜 | |
| D. | 1mol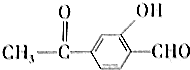 最多能与5mol H2发生反应 最多能与5mol H2发生反应 |
8.下列说法正确的是( )
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 铝能与冷水反应 | |
| C. | 铝热反应常用于冶炼某些熔点较高的金属 | |
| D. | 冶炼铝可用电解AlCl3的方法 |
15.用甲烷和二氧化碳可以制备化工原料.
(1)一定温度下,向容积恒定为2L的密闭容器中通人3molCO2、3molCH4,发生如下反应:
CO2(g)+CH4 (g)?2CO (g)+2H2(g)
反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等.请回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/(L.min);
②此温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC;(填选项字母)
A.v正(CH4)=2v 逆(H2) B.容器内压强保持恒定不变
C.反应中断裂2mol C一H键同时消耗lmolH2 D.容器内混合气体的密度保持恒定不变
④已知:
则反应CO2(g)+CH4(g)?2CO (g)+2H2(g)△H=+248kJ/mol.
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度(写两点).
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图所示:
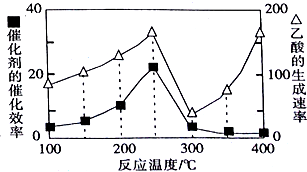
在250~400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,温度升高催化剂的催化效率降低,250~300℃之间催化剂为影响反应速率主要因素,乙酸的生成速率降低,而温度高于300℃后,温度是影响反应速率主要因素,乙酸的生成速率随温度升高而升高.
②250℃与400℃时乙酸的生成速率相近,请分析判断实际生产选择的最佳温度是250℃.
(1)一定温度下,向容积恒定为2L的密闭容器中通人3molCO2、3molCH4,发生如下反应:
CO2(g)+CH4 (g)?2CO (g)+2H2(g)
反应在2min末达到平衡状态,此时测得CO2和CO的体积分数相等.请回答下列问题:
①2min内,用H2来表示的反应速率v(H2)=0.5mol/(L.min);
②此温度下该反应的平衡常数K=1;
③下列叙述可以作为该反应达到平衡状态的标志的是BC;(填选项字母)
A.v正(CH4)=2v 逆(H2) B.容器内压强保持恒定不变
C.反应中断裂2mol C一H键同时消耗lmolH2 D.容器内混合气体的密度保持恒定不变
④已知:
| 物质 | H2 | CO | CH4 | CH3COOH |
| 燃烧热(kJ/mol) | 286 | 283 | 890 | 874 |
⑤为提高CH4的转化率,可以采取的措施是减小反应压强、增大CO2的浓度(写两点).
(2)在催化作用下,甲烷和二氧化碳还可以直接转化成乙酸.
①在不同温度下乙酸的生成速率如图所示:

在250~400℃范围内,乙酸的生成速率随温度变化的原因是温度超过250℃时,温度升高催化剂的催化效率降低,250~300℃之间催化剂为影响反应速率主要因素,乙酸的生成速率降低,而温度高于300℃后,温度是影响反应速率主要因素,乙酸的生成速率随温度升高而升高.
②250℃与400℃时乙酸的生成速率相近,请分析判断实际生产选择的最佳温度是250℃.
12.(1)现有可逆反应.2NO2(g)═N2O4(g),△H<0,试根据图象判断t2、t3、t4时刻采取的措施.
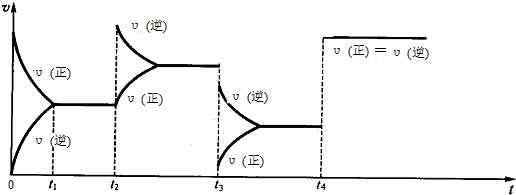
t2:增大生成物N2O4的浓度;t3:降低压强;t4:加入催化剂.
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如表数据:
(2)40s时,NO2的产率是50%.
(3)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L.s).
(4)在80℃时该反应的平衡常数K值为0.54(保留2位小数).
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
(6)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867 kJ/mol.

t2:增大生成物N2O4的浓度;t3:降低压强;t4:加入催化剂.
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如表数据:
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(3)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L.s).
(4)在80℃时该反应的平衡常数K值为0.54(保留2位小数).
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
(6)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867 kJ/mol.
13.下列有关说法正确的是( )
| A. | Na2CO3、NaHCO3固体都能受热发生分解 | |
| B. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| C. | Fe(OH)3胶体无色、透明,能产生丁达尔现象 | |
| D. | SiO2既能和氢氧化钠溶液反应有能和氢氟酸反应,所以是两性氧化物 |