题目内容
2.A-G均是中学常见化学物质,已知M是一种常用的氮肥,各物质间有如图转化关系.图中每一方格表示有关的一种反应物或生成物,其中A、C为无色气体.根据图中信息完成下列各小题: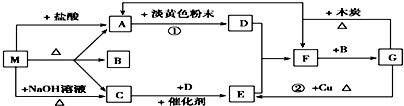
(1)物质M在加热时生成A、B、C的化学方程式为NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O
(2)反应①中,每生成1molD,转移电子的物质的量为2mol
(3)如何检验M中含有NH4+离子加入氢氧化钠溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,则证明NH4+存在.
(4)G和木炭在加热时反应的化学方程式为C+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O
(5)反应②的离子方程式3Cu+8H++2N03-=3Cu2++2NO↑+4H2O.
分析 M既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3,气体A能与淡黄色粉末反应生成D,应是二氧化碳与过氧化钠的反应,故A为CO2,则M应为(NH4)2CO3或NH4HCO3,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3,结合物质的性质进行解答.
解答 解:M既能与盐酸反应,又能与NaOH反应,都生成气体,应为弱酸铵盐,则C为NH3,气体A能与淡黄色粉末反应生成D,应是二氧化碳与过氧化钠的反应,故A为CO2,则M应为(NH4)2CO3或NH4HCO3,B为H2O,结合转化关系可知,D为O2,E为NO,F为NO2,G为HNO3.
(1)物质M在加热时生成A、B、C的化学方程式为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O等,
故答案为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O;
(2)反应①为:2Na2O2+2CO2=2Na2CO3+O2,每生成1mol氧气,转移电子的物质的量为1mol×2=2mol,
故答案为:2mol;
(3)检验M中含有NH4+离子:加入氢氧化钠溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,则证明NH4+存在,
故答案为:加入氢氧化钠溶液共热,产生能使湿润的红色石蕊试纸变蓝的气体,则证明NH4+存在;
(4)G和木炭在加热时反应的化学方程式为:C+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O,
故答案为:C+4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+CO2↑+2H2O;
(5)反应②是铜和稀硝酸反应生成硝酸铜、一氧化氮和水,离子方程式为:3Cu+8H++2N03-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2N03-=3Cu2++2NO↑+4H2O.
点评 本题考查无机物的推断,X能与酸、碱反应生成气体A、C为推断突破口,然后利用转化关系推出各物质,题目难度中等.

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案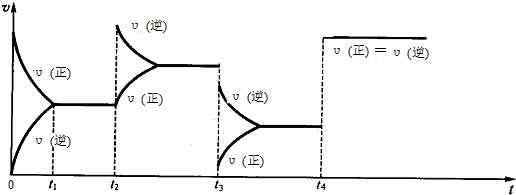
t2:增大生成物N2O4的浓度;t3:降低压强;t4:加入催化剂.
在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如表数据:
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(3)20s时,N2O4的浓度为0.14mol/L,0~20s内N2O4的平均反应速率为0.003mol/(L.s).
(4)在80℃时该反应的平衡常数K值为0.54(保留2位小数).
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时ABD.
A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大
(6)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2=-1160kJ/mol
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867 kJ/mol.
| A. | Na2CO3、NaHCO3固体都能受热发生分解 | |
| B. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| C. | Fe(OH)3胶体无色、透明,能产生丁达尔现象 | |
| D. | SiO2既能和氢氧化钠溶液反应有能和氢氟酸反应,所以是两性氧化物 |
| A. |  表示10 mL 0.01mol•L-1KMnO4酸性溶液与过量的0.1mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) | |
| B. |  表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. |  表示示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 | |
| D. |  表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
 乙苯催化脱氢制苯乙烯反应:
乙苯催化脱氢制苯乙烯反应: CH2CH3(g)$\stackrel{催化剂}{?}$
CH2CH3(g)$\stackrel{催化剂}{?}$ CH2═CH2(g)+H2(g)
CH2═CH2(g)+H2(g)(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{{a}^{2}}{(1-{a}^{2})}$p(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意如图:
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果.
②控制反应温度为600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大.
(4)某研究机构用CO2代替水蒸气开发了绿色化学合成工艺--乙苯-二氧化碳耦合催化脱氢制苯乙烯.保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度;该工艺中还能够发生反应:CO2+H2═CO+H2O,CO2+C═2CO.新工艺的特点有①②③④(填编号).
①CO2与H2反应,使乙苯脱氢反应的化学平衡右移
②不用高温水蒸气,可降低能量消耗
③有利于减少积炭 ④有利于CO2资源利用.
| A. | ①②④⑤ | B. | 仅②⑤ | C. | 仅②④⑤ | D. | ③④⑤ |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | O | F | |||||
| 3 | Na | Mg | P | S | Cl |
(2)CO2中存在的化学键为共价键.
(3)下列判断正确的是B
A、碱性强弱:Mg(OH)2>NaOH B、氢化物稳定性:HF>HCl C、酸性强弱:H3PO4>H2SO4.
| A. | 葡萄糖、蔗糖均能水解 | |
| B. | 福尔马林、水玻璃、一水合氨均为混合物 | |
| C. | 反应:NH4Cl (s)═NH3(g)+HCl(g)在室温下不能自发进行,说明该反应的△H>0 | |
| D. | C(石墨,s)═C (金刚石,s)△H=+1.9kJ•mol-1,说明金刚石比石墨稳定 |
| A. | H2燃烧热为285.8 kJ•mol-1,则2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| B. | 若C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则0.5mol NaOH固体与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2SO2(g)+O2(g)?2SO2 (g)△H=-196.64 kJ•mol-1,在一定温度下,向一固定体积的密闭容器中通入2mol SO2、1mol O2,达到平衡时放出热量小于196.64 kJ |