题目内容
2.2010年春,发生在滇、黔、桂、渝、川等省的严重旱情牵动了全国人民的心.水是组成生命体的重要化学物质,有关水的反应有很多.(1)水分子自身作用会生成阴、阳两种离子,其中阳离子的电子式是
 .
.(2)在由水电离产生的c(H+)=1×10-14 mol•L-1的溶液中,
①NH4+、Al3+、Br-、SO42-
②Na+、Mg2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3-
④K+、Na+、HCO3-、SO42-
四组离子中,一定可以大量共存的是③(填序号,下同),可能大量共存的是①②.
(3)在下列反应中,水仅做氧化剂的是CD(填字母,下同),水既不做氧化剂又不做还原剂的是AB.
A.Cl2+H2O=HCl+HClO
B.2Na2O2+2H2O=4NaOH+O2↑
C.CaH2+2H2O=Ca(OH)2+2H2↑
D.3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2
(4)“神舟七号”飞船上的能量主要来自于太阳能和燃料电池,H2、O2和KOH的水溶液可形成氢氧燃料电池,负极的电极反应为2H2+4OH--4e-=4H2O,电极反应产生的水经冷凝后可作为航天员的饮用水,当得到1.8L饮用水时,电池内转移的电子数约为200NA.
(5)如图是某品牌饮用矿泉水标签的部分内容.请认真阅读标签内容后计算.

①该矿泉水中镁离子的物质的量浓度的最大值是2×10-4mol•L-1;
②一瓶合格的这种矿泉水中硫酸根离子的物质的量不能超过1×10-4 mol.
分析 (1)两个水分子自身作用会生成阴、阳两种离子,阳离子为H3O+;
(2)由水电离产生的c(H+)=1×10-14mol•L-1的溶液,水的电离受到抑制,溶液可能呈碱性,也可能呈酸性,结合离子的性质判断;
(3)水仅做氧化剂,则水中H元素的化合价降低;水既不做氧化剂又不做还原剂,则水中H、O元素的化合价均不变化;
(4)H2、O2和KOH的水溶液可形成氢氧燃料电池,负极上氢气失去电子;结合物质的量及2H2+O2=2H2O计算转移电子;
(5)①由信息可知镁离子的浓度最大为4.8mg/L;
②酸根离子的浓度最大为19.2mg/L.
解答 解:(1)两个水分子自身作用会生成阴、阳两种离子,阳离子为H3O+,其电子式为 ,故答案为:
,故答案为: ;
;
(2)由水电离产生的c(H+)=1×10-14mol•L-1的溶液,水的电离受到抑制,溶液可能呈碱性,也可能呈酸性,
①酸性条件下不发生任何反应,可大量共存,但碱性条件下NH4+、Al3+不能大量共存;
②酸性条件下不发生任何反应,可大量共存,但碱性条件下Mg2+不能大量共存;
③溶液无论呈酸性还是碱性,离子之间都不发生任何反应,可大量共存;
④溶液无论呈酸性还是碱性,HCO3-离子都不能大量存在.
故答案为:③;①②;
(3)A.Cl2+H2O═HCl+HClO中,只有Cl元素的化合价变化,水既不是氧化剂也不是还原剂;
B.2Na2O2+2H2O═4NaOH+O2↑中,只有过氧化钠中O元素的化合价变化,水既不是氧化剂也不是还原剂;
C.CaH2+2H2O═Ca(OH)2+2H2↑中,水中H元素的化合价降低,则水为氧化剂;
D.3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2中,水中H元素的化合价降低,则水为氧化剂,
故答案为:CD;AB;
(4)H2、O2和KOH的水溶液可形成氢氧燃料电池,负极上氢气失去电子,负极反应为2H2+4OH--4e-=4H2O,得到1.8L饮用水时,水的物质的量为$\frac{1.8×1{0}^{3}g}{18g/mol}$=100mol,由2H2+O2=2H2O中转移4e-可知,转移电子数为100mol×2×NA=200NA,
故答案为:2H2+4OH--4e-=4H2O;200NA;
(5)①由信息可知镁离子的浓度最大为4.8mg/L,物质的量浓度为$\frac{\frac{4.8×1{0}^{-3}}{24}mol}{1L}$=2×10-4mol•L-1,
故答案为:2×10-4mol•L-1;
②酸根离子的浓度最大为19.2mg/L,则500mL时硫酸根离子为0.5L×19.2mg/L=9.6mg,其物质的量为$\frac{9.6×1{0}^{-3}g}{96g/mol}$=1×10-4mol,
故答案为:1×10-4.
点评 本题考查较综合,涉及离子共存、氧化还原反应、原电池及物质的量浓度的计算等,注重高频考点的考查,综合性较强,题目难度中等.

 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案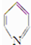 )与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
)与苯环性质相似.有机物M与磷酸在一定条件下形成磷酸吡醛,磷酸吡醛是细胞的重要组成部分.下列说法不正确的是( )
| A. | M能使酸性高锰酸钾溶液褪色 | |
| B. | 1molM与金属钠反应,消耗2mol Na | |
| C. | 1mol磷酸吡醛与NaOH溶液反应,最多消耗3mol NaOH | |
| D. | M与足量H2反应后所得有机物的分子式为C8H17O3N |
| A. | 加稀盐酸 | B. | 加NaOH溶液 | C. | 焰色反应 | D. | 加热 |
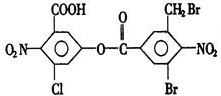
| A. | 5mol | B. | 6mol | C. | 7mol | D. | 8mol |
| A. | 浓硫酸 | B. | 稀硫酸 | C. | 浓盐酸 | D. | 稀硝酸 |
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| C. | 分液时,上层液体要从分液漏斗上口倒出 | |
| D. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 |
| A. | 足量Zn与一定量的浓硫酸反应,产生22.4 L(标况)气体时,转移的电子数一定为2NA | |
| B. | 2 molSO2和1 molO2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2 NA | |
| C. | 71g氯气通入足量水中,反应中转移的电子总数为NA | |
| D. | 6 g SiO2晶体中含有的硅氧键数为0.4NA |
 .
.