题目内容
15.下列有关0.1mol/L HNO3溶液的叙述正确的是( )| A. | 加入Na2S2O3溶液,无明显现象 | |
| B. | 该溶液中Na+、K+、SiO32-、SO42-可以大量共存 | |
| C. | 加入FeCO3粉末,发生反应的离子方程式为:2FeCO3+2H+=2Fe2++CO2↑+H2O | |
| D. | 加入过量Cu粉和足量稀硫酸,可使溶液中几乎不含N元素 |
分析 A.HNO3是强氧化剂,硫代硫酸钠中硫元素被氧化为硫酸根,硝酸中氮元素被还原为一氧化氮;
B.硝酸为强酸,H+与SiO32-不能大量共存;
C.硝酸具有强的氧化性,能够氧化二价铁离子;
D. 加入过量Cu粉和足量稀硫酸,HNO3全部被还原为NO.
解答 解:A.HNO3是强氧化剂,硫代硫酸钠中硫元素被氧化为硫酸根,根据氧化还原反应的实质得失电子守恒,S2O32-→2SO42-~8e-,HNO3→NO~3e-,离子方程式为:3S2O32-+8NO3-+2H+=6SO42-+8NO↑+H2O,现象为有无色气体产生,且该气体在空气中逐渐变红棕色,故A错误;
B.硝酸为强酸,硝酸电离出的H+与SiO32-反应:2H++SiO32-=H2SiO3↓,形成硅酸沉淀,不能大量共存,故B错误;
C.加入FeCO3粉末,发生反应的离子方程式为:3FeCO3+NO3-+10H+=3Fe3++3CO2↑+NO↑+5H2O,故C错误;
D.Cu与稀HNO3反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,加入过量Cu粉和足量稀硫酸,HNO3几乎全部被还原为NO,可使溶液中几乎不含N元素,故D正确;
故选D.
点评 本题考查了硝酸的性质,熟悉硝酸的强氧化性是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列有关(NH4)Al(SO4)2溶液的叙述正确的是( )
| A. | 能大量存在:Na+、C6H5O-、Cl-、Br- | |
| B. | 同温下通入少量的氨气:NH4+的水解能力增强,Kw增大,有白色沉淀产生 | |
| C. | 加入Ba(OH)2溶液生成沉淀质量最多的离子方程式:NH4++Al3++2Ba2++5OH-+2SO42-=2BaSO4↓+AlO2-+NH3•H2O+2H2O | |
| D. | 其浓溶液可与NaHCO3溶液混合制成灭火器 |
6.已知300℃、70MPa下由二氧化碳和氢气合成乙醇的反应成为现实:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H<0.在温度为T℃,容积不变的V L密闭容器中,将3mol H2和1mol CO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是( )
| A. | 升高温度,该反应的平衡常数将增大 | |
| B. | 从平衡混合气中分离出水蒸气可提高CO2和H2的利用率 | |
| C. | 再向该容器中充入2 mol H2和1 mol CO2,达到平衡时,H2的转化率将小于CO2 | |
| D. | T℃,在起始体积为V L的密闭容器(容积可变,恒压)中将3 mol H2和1 mol CO2混合,达到平衡时乙醇体积分数大于a |
3.化学与资源、环境、生活关系密切,下列说法正确的是( )
| A. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| B. | “氟化物防治龋齿”是应用了沉淀转化的原理,产生更能抵抗酸侵蚀的物质 | |
| C. | 使用增塑剂-邻苯二甲酸酯可使聚氯乙烯由弹性塑胶变为硬塑胶 | |
| D. | 面粉生产中禁止添加的过氧化钙(CaO2)中阴阳离子的个数比为1:2 |
10.下列实验原理、实验操作及结论正确的是( )
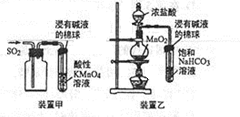

| A. | 用装置甲收集SO2并验证其漂白性 | |
| B. | 用装置乙验证氯气与水反应有盐酸生成 | |
| C. | 用澄清石灰水鉴别苏打溶液和小苏打溶液,出现白色沉淀的为苏打溶液 | |
| D. | 向足量含淀粉的Fel2溶液中滴加2滴新制氯水,溶液变蓝,说明还原性:I->Fe2+ |
20.中华先人在以化学为核心的诸多领域取得了辉煌成就,为人类社会的发展做出了杰出贡献,下列中国古代发明的产物与有机物无关的是( )
①青铜冶炼②酿酒酿醋③制造火药④做豆腐⑤制饴糖⑥炼金丹⑦树皮造纸⑧制陶瓷.
①青铜冶炼②酿酒酿醋③制造火药④做豆腐⑤制饴糖⑥炼金丹⑦树皮造纸⑧制陶瓷.
| A. | ①⑤⑥⑧ | B. | ①③⑥⑧ | C. | ③⑤⑥⑦ | D. | ②④⑦⑧ |
7.下列说法正确的是( )
| A. | 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 | |
| B. | 可采取加热蒸发的方法使FeCl3从水溶液中结晶析出 | |
| C. | NaAlO2浓液中滴加Na2C03溶液,有沉淀和气体生成 | |
| D. | 将SO2分别通入硝酸钡溶液和溶有氨气的氯化钡溶液中,产生沉淀的成分相同 |
4.下列说法不正确的是( )
| A. | 实验探究Zn-Cu及稀硫酸原电池工作原理,在稀硫酸溶液中加少量重铬酸钾因其有去极化作用可延长灯泡发亮时间,重铬酸钾也可用 KMnO4、MnO2等强氧化性物质代替 | |
| B. | 一些有机溶剂(如乙醚、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热 | |
| C. | 在醋酸钠溶液中滴人酚酞试液,加热后红色加深,可证明盐类水解是吸热反应 | |
| D. | 可使用溴水鉴别植物油和汽油 |

 .
. .
. $\stackrel{P_{2}O_{5}}{→}$
$\stackrel{P_{2}O_{5}}{→}$ .化合物
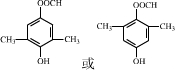
.化合物 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
为原料合成该化合物(用合成路线流程图表示,并注明反应条件).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$