题目内容
水热法制备Fe3O4纳米颗粒的化学方程式为:3Fe++2S2O
+O2+4OH-=Fe3O4+X+2H2O.下列有关说法不正确的是( )
2- 3 |
| A、上式中的X为S4O62- |
| B、该反应中的还原剂为Fe2+和S2O32- |
| C、当生成1 mol Fe3O4时,转移电子的物质的量为4 mol |
| D、当3 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1 mol |
考点:氧化还原反应
专题:氧化还原反应专题
分析:由原子和电荷守恒可知,X为S4O62-,3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,Fe元素的化合价由+2价升高为+3价,S元素的化合价升高,只有氧气中O元素的化合价降低,该反应中转移4e-,以此来解答.
解答:
解:A.由原子和电荷守恒可知,X为S4O62-,故A正确;
B.Fe、S元素的化合价升高,O元素的化合价降低,则O2是氧化剂,S2O32-和Fe2+是还原剂,故B正确;
C.生成1molFe3O4,由O元素的化合价变化可知,转移电子数为1mol×2×(2-0)=4mol,故C正确;
D.若有3mol Fe2+ 参加反应,由电子守恒可知,则被Fe2+还原的O2为
=0.75mol,故D错误;
故选D.
B.Fe、S元素的化合价升高,O元素的化合价降低,则O2是氧化剂,S2O32-和Fe2+是还原剂,故B正确;
C.生成1molFe3O4,由O元素的化合价变化可知,转移电子数为1mol×2×(2-0)=4mol,故C正确;
D.若有3mol Fe2+ 参加反应,由电子守恒可知,则被Fe2+还原的O2为
| 3mol×(3-2) |
| 2×(2-0) |
故选D.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重电子转移及电子守恒的考查,注意选项C、D为解答的易错点,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
下列叙述中错误的是( )
| A、若将等量的硫蒸汽和硫固体分别完全燃烧,恢复到原状态,前者放出的热量多 |
| B、I2、SO3、固态氩都属于分子晶体 |
| C、1 molO2在反应中作氧化剂时,所得电子数一定为4NA |
| D、ag铁粉与含有H2SO4的CuSO4溶液恰好完全反应后,得到的固体为a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为2:7 |
某同学用如图装置研究电化学实验,下列叙述正确的是( )
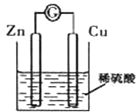

| A、铜为负极,产生气泡 |
| B、溶液变蓝色 |
| C、电子从锌极经导线流向铜极 |
| D、Zn、Cu 分别接外加电源的正、负极可在锌极镀上铜 |
下列有关化学基本概念的判断不正确的是( )
①溶液与胶体的本质区别是能否发生丁达尔效应
②根据是否仅含一种元素分为纯净物与混合物
③氧化还原反应的本质是反应前后元素化合价变化
④强电解质与弱电解质本质区别水溶液中导电性强弱
⑤根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
⑥MgO、Na2O2、CuO、Al2O3都是金属氧化物,也是碱性氧化物.
①溶液与胶体的本质区别是能否发生丁达尔效应
②根据是否仅含一种元素分为纯净物与混合物
③氧化还原反应的本质是反应前后元素化合价变化
④强电解质与弱电解质本质区别水溶液中导电性强弱
⑤根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
⑥MgO、Na2O2、CuO、Al2O3都是金属氧化物,也是碱性氧化物.
| A、①②④ | B、③⑤⑥ |
| C、④⑤ | D、全部错误 |
下列关于摩尔质量的说法正确的是( )
| A、水的摩尔质量是18g |
| B、2mol水的摩尔质量是1mol水摩尔质量的2倍 |
| C、任何物质的摩尔质量都就是它的相对分子质量或相对原子质量 |
| D、水的摩尔质量是氢气摩尔质量的9倍 |
运用相关化学知识进行判断,下列结论错误的是( )
| A、增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
| B、NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C、可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D、需要加热的反应不一定是吸热反应 |




 (1)实验室里一些看似简单的基本操作往往需要方法或技巧,下表中A栏列出操作的要求或目的,请在对应B栏中填上相应的操作方法或技巧:
(1)实验室里一些看似简单的基本操作往往需要方法或技巧,下表中A栏列出操作的要求或目的,请在对应B栏中填上相应的操作方法或技巧: