题目内容
甲同学想通过下图所示装置(夹持装置已略去)进行实验,研究推断SO2与Na2O2反应的产物.回答下列问题:
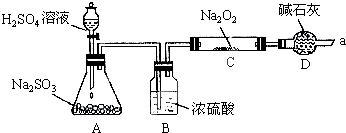
(1)装置B的作用 .装置D的作用 .
(2)如何检验反应中是否有氧气生成 .
(3)假如Na2O2已反应完全,为确定C中固体产物的成分,甲设计如下实验:
 得出结论:产物是Na2SO4,该方案是否合理 (填是或否),理由是 .
得出结论:产物是Na2SO4,该方案是否合理 (填是或否),理由是 .

(1)装置B的作用
(2)如何检验反应中是否有氧气生成
(3)假如Na2O2已反应完全,为确定C中固体产物的成分,甲设计如下实验:
 得出结论:产物是Na2SO4,该方案是否合理
得出结论:产物是Na2SO4,该方案是否合理考点:性质实验方案的设计
专题:实验设计题
分析:A用于制备二氧化硫气体,B干燥装置,除去二氧化硫中的水蒸气,防止水与过氧化钠反应而影响实验结论,D可用于吸收二氧化硫,防止污染空气,并吸收空气中的水和二氧化碳,防止与过氧化钠反应,如能生成氧气,可用带有余烬的木条检验,假如Na2O2已反应完全,为确定C中固体产物的成分是否为Na2SO4,应先加入盐酸酸化,再加入氯化钡检验,注意不能用硝酸,防止亚硫酸钠被硝酸氧化,以此解答该题.
解答:
解:(1)因生成的二氧化硫混有水蒸气,为防止较多的水蒸气与过氧化钠反应,应先用浓硫酸干燥,二氧化硫有毒,不能直接排空,二氧化硫是酸性氧化物能和碱性物质反应,所以用碱石灰吸收二氧化硫防止污染空气,且D可吸收空气中的水和二氧化碳,防止与过氧化钠反应,
故答案为:干燥二氧化硫,防止较多的水蒸气与过氧化钠反应;防止空气中的水和二氧化碳进入C装置与过氧化钠反应,同时吸收过量的二氧化硫,以免污染空气;
(2)氧气的检验方法是:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成,否则没有,
故答案为:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成;
(3)亚硫酸钠和氯化钡反应生成亚硫酸钡,硝酸有强氧化性,能把亚硫酸钡氧化生成硫酸钡,干扰了亚硫酸根离子的检验,所以该方案不合理,
故答案为:否;稀硝酸能将生成的BaSO3 氧化为BaSO4而使沉淀不溶于稀硝酸.
故答案为:干燥二氧化硫,防止较多的水蒸气与过氧化钠反应;防止空气中的水和二氧化碳进入C装置与过氧化钠反应,同时吸收过量的二氧化硫,以免污染空气;
(2)氧气的检验方法是:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成,否则没有,
故答案为:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成;
(3)亚硫酸钠和氯化钡反应生成亚硫酸钡,硝酸有强氧化性,能把亚硫酸钡氧化生成硫酸钡,干扰了亚硫酸根离子的检验,所以该方案不合理,
故答案为:否;稀硝酸能将生成的BaSO3 氧化为BaSO4而使沉淀不溶于稀硝酸.
点评:本题考查了物质的性质实验设计,为高频考点,侧重于学生的分析能力的考查,注意把握实验的原理,难度不大,会根据题中给予信息分析问题、解决问题.

练习册系列答案
 优加精卷系列答案
优加精卷系列答案
相关题目
已知Ksp(FeS)=6.3×10-18,Ksp(CuS)=6.3×10-36,K1(H2S)=1.3×10-20. 向0.10mol?L-1Fe2+和0.10mol?L-1Cu2+的混合溶液中通入H2S气体至饱和(c(H2S) 0.10mol?L-1).请推断沉淀生成情况是下列哪一种( )
| A、先生成CuS 沉淀,后生成FeS 沉淀 |
| B、先生成FeS 沉淀,后生成CuS 沉淀 |
| C、先生成CuS 沉淀,不生成FeS 沉淀 |
| D、先生成CuS 沉淀,反应一段时间FeS和CuS同时沉淀 |



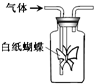 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是( )



