题目内容
20.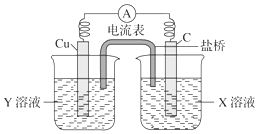 (1)利用反应Cu+2FeCl3═CuCl2+2FeCl2设计成如图所示的原电池,回答下列问题:
(1)利用反应Cu+2FeCl3═CuCl2+2FeCl2设计成如图所示的原电池,回答下列问题:①写出电极反应式:
正极2Fe3++2e-═2Fe2+;
负极Cu-2e-═Cu2+.
②图中X溶液是FeCl3,Y溶液是CuCl2.
③原电池工作时,盐桥中的阳(填“阳”、“阴”)离子向X溶液方向移动.
(2)该电池向外提供0.2mol电子,负极材料的质量变化为减少6.4g,假设该电解质溶液为1L,则以Fe3+浓度变化为减少0.2mol/L.
(3)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为O2+4e-+4H+═2H2O.
分析 (1)根据电池总反应式Cu+2FeCl3═CuCl2+2FeCl2可知Cu元素化合价由0价变为+2价、Fe元素化合价由+3价变为+2价,所以Cu作负极,C作正极,利用盐桥组成原电池,将氧化剂FeCl3和还原剂Cu分开,盐桥中阳离子移向正极,阴离子移向负极,据此解题;
(2)根据转移电子与Cu的关系式计算消耗Cu的质量;根据转移电子计算消耗的铁离子物质的量,再计算浓度的变化;
(3)正极发生的是化合价降低得电子的反应.
解答 解:(1)①根据电池总反应式Cu+2FeCl3═CuCl2+2FeCl2可知Cu失电子作负极,电极反应为:Cu-2e-═Cu2+;正极是三价铁离子得电子生成亚铁离子,电极反应为2Fe3++2e-═2Fe2+,
故答案为:2Fe3++2e-═2Fe2+;Cu-2e-═Cu2+;
②利用盐桥组成原电池,将氧化剂FeCl3和还原剂Cu分开,则Y是CuCl2溶液,X是FeCl3溶液,
故答案为:FeCl3;CuCl2;
③原电池工作时,盐桥中的阳离子向正极移动,即X溶液方向移动,
故答案为:阳;
(2)根据负极反应Cu-2e-=Cu2+可知消耗1mol铜,转移2mol电子,故转移0.2mol电子,消耗的铜为0.1mol,质量为0.1mol×64g/mol=6.4g;正极反应2Fe3++2e-═2Fe2+,所以消耗Fe3+的物质的量为0.2mol,则Fe3+浓度变化为△c=$\frac{△n}{V}$=$\frac{0.2mol}{1L}$=0.2mol/L,
故答案为:减少6.4g;减少0.2mol/L;
(3)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:O2+4e-+4H+═2H2O,
故答案为:O2+4e-+4H+═2H2O.
点评 本题考查了原电池的设计,根据方程式中元素化合价升降进行判断,方程式中失电子化合价升高的金属单质作负极,得电子化合价降低的化合物为其电解质,难度中等.

| A. | 干燥剂硅胶和硅橡胶的主要化学成分都是二氧化硅 | |
| B. | 手机外壳上贴的碳纤维外膜是一种新型无机非金属材料 | |
| C. | 用淀粉溶液可以直接检验海水中是否含碘元素 | |
| D. | 明矾净水的原理和“84”消毒液消毒的原理相同 |
| A. | Al2O3 | B. | SiO2 | C. | NO2 | D. | CO |
| A. | FeCl3 | B. | CuS | C. | HCl | D. | Fe3O4 |
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 分子间作用力越大,分子越稳定 | ||
| C. | 冰融化时分子中共价键发生断裂 | D. | 原子晶体中共价键越强,熔点越高 |
| A. | 反应停止了 | |
| B. | NO的正反应速率与O2的逆反应速率相等 | |
| C. | c(NO):c(O2)=2:1 | |
| D. | 气体的颜色不再变化 |
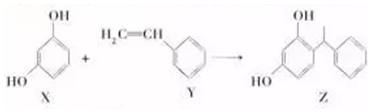
下列说法中错误的是( )
| A. | lmolX与溴水反应消耗3molBr2 | |
| B. | X能与Na2CO3溶液反应 | |
| C. | Y既能发生取代反应,也能发生加成反应 | |
| D. | 用酸性KMnO4溶液可鉴别X、Y |
| A. | 同一主族的元素从上到下金属性逐渐减弱 | |
| B. | 元素周期表是元素周期律的具体表现形式 | |
| C. | 同一周期从左到右,元素原子半径逐渐增大 | |
| D. | 非金属元素的最高正化合价等于它的负化合价的绝对值 |
