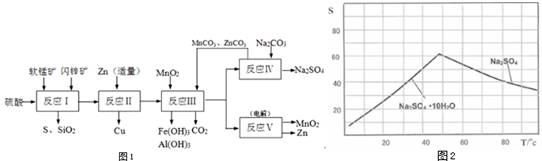
题目内容
8.下列化合物不能由单质直接化合而成的是( )| A. | FeCl3 | B. | CuS | C. | HCl | D. | Fe3O4 |
分析 S具有弱氧化性,与变价金属反应生成低价金属硫化物,氯气具有强氧化性,与变价金属反应生成高价金属氯化物,S与氧气反应生成二氧化硫,以此来解答.
解答 解:A.铁与氯气反应生成三氯化铁,所以FeCl3能由单质直接化合而制成,故A不选;
B.Cu与S反应化合生成Cu2S,故B选;
C.氢气在氯气中燃烧可生成HCl,故C不选;
D.铁在氧气中燃烧可生成Fe3O4,故D不选.
故选B.
点评 本题考查金属化合物的性质,为高频考点,把握物质的性质、氧化还原反应为解答的关键,侧重分析与应用能力的考查,注意元素和化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
16.在2L0.1mol•L-1 Na2SO4溶液中,下列说法正确的是( )
| A. | Na+物质的量为0.2mol | B. | Na+物质的量浓度为0.2 mol•L-1 | ||
| C. | SO42-物质的量为0.1mol | D. | SO42-物质的量浓度为0.2 mol•L-1 |
3.下列有关说法错误的是( )
| A. | 磷原子的质子数为14 | B. | 氧元素在第二周期 | ||
| C. | 氯元素的最高化合价为+7 | D. | 还原性 Na<K |
13.在任何条件下,纯水显中性,是因为( )
| A. | PH=7 | B. | c(H+)=c(OH-) | ||
| C. | c(H+)=c(OH-)=10-7mol/L | D. | c(H+)•c(OH-)=10-14 |
17.已知2H2O2(1)═2H2O(1)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是( )

| A. | 该反应的△H<0,△S>0 | |
| B. | 途径Ⅱ与途径I相比,可能是加了催化剂 | |
| C. | 其他条件相同时,产生相同体积的氧气时放出的热量:途径I>途径Ⅱ | |
| D. | 其他条件相同时,产生相同体积的氧气所需的时间:途径I>途径Ⅱ |
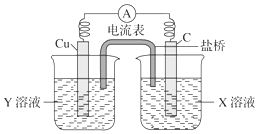 (1)利用反应Cu+2FeCl3═CuCl2+2FeCl2设计成如图所示的原电池,回答下列问题:
(1)利用反应Cu+2FeCl3═CuCl2+2FeCl2设计成如图所示的原电池,回答下列问题: