题目内容
14.味精是烹制菜肴时常用的调味品,其主要成分是谷氨酸钠(化学式为C5H8NO4Na).谷氨酸钠有鲜味,易溶于水.某品牌味精包装上标注:“谷氨酸钠含量≥80%,NaCl含量≤20%”.某学校化学科研小组现对此味精中NaCl的含量进行测定.查阅资料:资料表明,谷氨酸钠的存在不影响NaCl含量的测定.该小组同学设计的实验方案如图所示:

根据上述实验步骤回答下列有关问题:
(1)操作1所需要的玻璃仪器有普通漏斗、烧杯、玻璃棒;
(2)用简明扼要的语言描述操作2的过程:沿玻璃棒向漏斗中注入蒸馏水,直至恰好淹没沉淀物,待水自然流尽后,重复上述操作2~3次;
(3)加水溶解所得溶液A为50mL,则溶液A中NaCl的物质的量浓度是0.4mol•L-1.
分析 味精加水溶解得到的溶液A为谷氨酸钠溶液和氯化钠溶液,然后加入AgNO3,发生的反应是Ag++Cl-=AgCl↓,得到的氯化银为2,87g,据此求算出氯元素的物质的量,并根据氯元素守恒,得到氯化钠的物质的量,并求其质量,并分析达不达标,
(1)依据溶液中分离出固体的实验操作是过滤,依据过滤实验装置分析需要的玻璃仪器;
(2)操作2的过程为沿玻璃棒向漏斗中注入蒸馏水,直至恰好淹没沉淀物,待水自然流尽后,重复上述操作2~3次;
(3)依据沉淀质量计算物质的量根据氯元素守恒得到氯化钠物质的量,依据c=$\frac{n}{v}$计算得到溶液浓.
解答 解:味精加水溶解得到的溶液A为谷氨酸钠溶液和氯化钠溶液,然后加入AgNO3,发生的反应是Ag++Cl-=AgCl↓,得到的氯化银为2,87g,据此求算出氯元素的物质的量,并根据氯元素守恒,得到氯化钠的物质的量,并求其质量,并分析达不达标,
(1)溶液中分离出固体的实验操作是过滤,需要的玻璃仪器为普通漏斗 烧杯 玻璃棒;
故答案为:普通漏斗、烧杯、玻璃棒;
(2)操作2的过程为沿玻璃棒向漏斗中注入蒸馏水,直至恰好淹没沉淀物,待水自然流尽后,重复上述操作2~3次;
故答案为:沿玻璃棒向漏斗中注入蒸馏水,直至恰好淹没沉淀物,待水自然流尽后,重复上述操作2~3次;
(3)生成的氯化银沉淀质量2.87g,物质的量=$\frac{2.87g}{143.5g/mol}$=0.02mol,根据氯元素守恒,A溶液中含有氯化钠物质的量为0.02mol,溶液A为50mL,则溶液A中NaCl的物质的量浓度=$\frac{0.02mol}{0.05L}$=0.4mol/L;
故答案为:0.4mol/L
点评 本题考查了物质组成的实验测定实验设计和计算应用,主要是实验基本操作的应用,掌握基础是解题关键,题目难度中等.

 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案| A. | 金属元素和非金属分界线附近的元素 | |
| B. | 左、下方区域的金属元素 | |
| C. | 右、上方区域的非金属元素 | |
| D. | 稀有气体元素 |
| A. | C2H4 | B. | Cl2 | C. | NH3 | D. | NO |
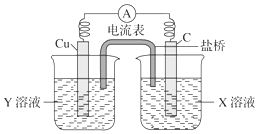 (1)利用反应Cu+2FeCl3═CuCl2+2FeCl2设计成如图所示的原电池,回答下列问题:
(1)利用反应Cu+2FeCl3═CuCl2+2FeCl2设计成如图所示的原电池,回答下列问题: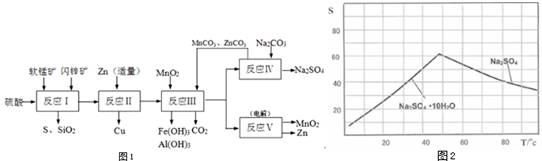
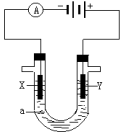 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.回答以下问题: 某学习小组用如图装置测定镁铝合金中铝的质量分数.
某学习小组用如图装置测定镁铝合金中铝的质量分数. 一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.