题目内容
6.短周期元素的四种离子A2+、B+、C2-、D-具有相同电子层结构,下列叙述正确的是( )| A. | 原子序数:D>C>B>A | B. | 氢化物的稳定性:H2C>HD | ||
| C. | 离子半径:C2->D->B+>A2+ | D. | 氧化性:A2+>B+,还原性:C2-<D- |
分析 短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,结合离子所得电荷可知,C、D为非金属元素,应处于第二周期,故C为O元素,D为F元素,A、B为金属应处于第三周期,A为Mg元素,B为Na元素,结合元素周期律解答.
解答 解:短周期元素的离子:aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,结合离子所得电荷可知,C、D为非金属元素,应处于第二周期,故C为O元素,D为F元素,A、B为金属应处于第三周期,A为Mg元素,B为Na元素.
A.原子序数:A(Mg)>B(Na)>D(F)>C(O),故A错误;
B.同周期随原子序数增大非金属性增强,故非金属性O<F,非金属性越强,氢化物越稳定,则稳定性H2O<HF,故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->F->Na+>Mg2+,故C正确;
D.金属性越强,其阳离子的氧化性越弱,金属性为Na>Mg,则氧化性:Mg2+>Na+,非金属性越强,阴离子还原性越弱,非金属性:O<F,则还原性:O2->F-,故D错误;
故选:C.
点评 本题考查结构与位置关系、元素周期律等,难度中等,注意元素周期律的理解掌握,也可以根据电荷与核外电子排布相同推断元素在周期表中的位置而不需要推断具体的元素.

练习册系列答案
相关题目
16.分别用一种试剂将下列物质中的少量杂质除去(括号内为混入的杂质).
| 物 质 | 需加入的试剂 | 有关离子方程式 |
| HNO3(HCl) | ||
| ZnSO4(CuSO4) | ||
| NaCl(Na2CO3) |
1.常温下,下列指定溶液中一定能大量共存的是( )
| A. | 无色透明溶液中:K+、Cu2+、SO42-、Na+ | |
| B. | pH=12的溶液中:K+、Na+、SO42-、CH3COO-、CO32- | |
| C. | 加入铝片能放出H2的溶液中:Na+、HCO3-、Cu2+、SO42- | |
| D. | 由水电离出的c(H+)=1×10-12 mol/L的溶液中:NH4+、Ba2+、NO3-、Cl- |
11.化学原理的利用对人类生产生活具有重要的作用.
(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间.
某地海水中主要离子的含量如下表:
①海水显弱碱性的原因是(用离子方程式表示):HCO3-+H2O?H2CO3+OH-,
②工业上常用饱和食盐水为原料制备氯气,反应的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+Cl2↑+H2↑.
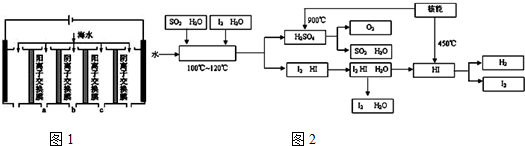
③电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
a.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O.
b.淡水的出口为a、b、c中的b出口.
(2)科学家预测“氢能”将是未来最理想的新能源.
①实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 KJ/mol.
②如图2是某国正在研究中的一种流程(硫-碘热循环法制氢气),其中用了过量的碘.如图2方框中发生的化学反应方程式:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$2HI+H2SO4.
(1)海洋资源的开发与利用具有广阔的前景.海水的pH一般在7.5~8.6之间.
某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/(mg•L-1) | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
②工业上常用饱和食盐水为原料制备氯气,反应的化学反应方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$ 2NaOH+Cl2↑+H2↑.
③电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图1所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.
a.电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O.
b.淡水的出口为a、b、c中的b出口.

(2)科学家预测“氢能”将是未来最理想的新能源.
①实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8 KJ/mol.
②如图2是某国正在研究中的一种流程(硫-碘热循环法制氢气),其中用了过量的碘.如图2方框中发生的化学反应方程式:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$2HI+H2SO4.
18.有X、Y、Z、M四种金属,已知:M投入水中可与水剧烈反应;用X和Z作电极,稀硫酸作电解质溶液构成原电池时,Z有气泡产生; Y和Z的离子共存于电解液中电解,阴极析出Y.则这四种金属的活动性由强到弱的顺序是( )
| A. | X>Z>Y>M | B. | X>M>Z>Y | C. | M>Y>Z>X | D. | M>X>Z>Y |
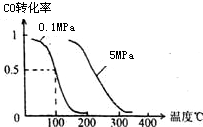 (1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
(1)在一定条件下,容积为 10L密闭容器中发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0