题目内容
写出氯化铁在水溶液中的电离方程式: .
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:强电解质的电离利用“═”,并遵循电荷守恒、质量守恒定律,据此分析.
解答:
解:氯化铁是强电解质在溶液中完全电离出氯离子和三价铁离子,其电离方程式为:FeCl3═Fe3++3Cl-;
故答案为:FeCl3═Fe3++3Cl-.
故答案为:FeCl3═Fe3++3Cl-.
点评:本题考查电离方程式的书写,注意电离方程式应遵循电荷守恒、质量守恒定律,题目难度不大.

练习册系列答案
相关题目
计算:
(1)在0.5molH2O中,所含有分子数 ,原子数 ,电子数 .
(2)标准状况下:5.6LO2的物质的量是 ,质量是 .
(3)将58.5g的NaCl配制成2L溶液,该溶液的物质的量的浓度为 .
(1)在0.5molH2O中,所含有分子数
(2)标准状况下:5.6LO2的物质的量是
(3)将58.5g的NaCl配制成2L溶液,该溶液的物质的量的浓度为
对于反应A(g)+2B(g)?2C(g)△H<0的平衡常数为K,下列说法正确的是( )
| A、温度越高,K越大 |
| B、压强越大,K越大 |
| C、K越大,反应速率越大 |
| D、K越大,C的百分含量越大 |
 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.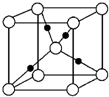 有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH
有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH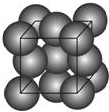 金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.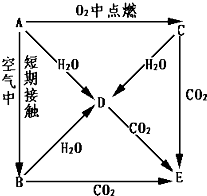 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按图所示关系相互转化,已知A金属为单质.