题目内容
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下: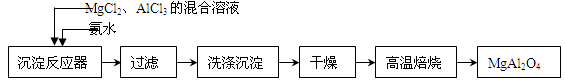
⑴制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
⑵如图所示,过滤操作中的一处错误是 。判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。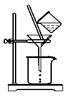
⑶在25℃下,向浓度均为0.01 mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式),生成该沉淀的离子方程式_______ ______________
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10 -34。)
⑷无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。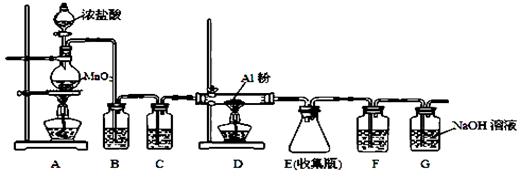
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ; F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
⑸将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
(1) 2 Al(OH)3+Mg (OH)2 MgAl2O4 + 4H2O
MgAl2O4 + 4H2O
(2)漏斗下端尖嘴未紧贴烧杯内壁 AgNO3溶液(或硝酸酸化的AgNO3溶液);坩埚
(3)Al(OH)3 Al3++ 3NH3·H2O=Al(OH)3↓+ 3NH4+
(4)除去HCl;吸收水蒸气;碱石灰(或NaOH与CaO混合物)
(5)8.00
解析
试题分析:(1)向MgCl2、AlCl3的混合溶液中加入过量的氨水,发生反应:MgCl2+ 2NH3·H2O=Mg(OH)2↓+ 2NH4Cl;AlCl3+ 3NH3·H2O=Al(OH)3↓+ 3NH4Cl;然后把Al(OH)3、Mg (OH)2沉淀过滤出来,并洗涤干净、干燥,最后高温灼烧发生反应2Al(OH)3+Mg (OH)2 MgAl2O4 + 4H2O。即得到要制备MgAl2O4。⑵在如图所示的过滤操作中的错误是漏斗下端尖嘴未紧贴烧杯内壁。由于沉淀是从金属氯化物中过滤出来的,所以要判断流程中沉淀是否洗净的方法就是用硝酸酸化的AgNO3溶液来检验是否含有Cl-即可。高温焙烧时,要用坩埚来盛放固体物质。⑶Mg2+形成沉淀需要的
MgAl2O4 + 4H2O。即得到要制备MgAl2O4。⑵在如图所示的过滤操作中的错误是漏斗下端尖嘴未紧贴烧杯内壁。由于沉淀是从金属氯化物中过滤出来的,所以要判断流程中沉淀是否洗净的方法就是用硝酸酸化的AgNO3溶液来检验是否含有Cl-即可。高温焙烧时,要用坩埚来盛放固体物质。⑶Mg2+形成沉淀需要的 ;而Al3+形成沉淀需要的
;而Al3+形成沉淀需要的 <4.242×10-5。需要的OH-的浓度越小,越容易形成沉淀。因此首先形成的是Al(OH)3沉淀。(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是除去氯气中杂质气体HCl,同时减小氯气的溶解。由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,所以在F中试剂的作用是吸收水蒸气,防止无水AlCl3水解。用干燥管装填碱石灰也可起到F和G的作用。⑸Mg、Cu与硝酸发生反应变为Mg2+、Al3+时失去的电子的物质的量与HNO3得到电子的物质的量相等。而当向反应后的溶液中加入NaOH溶液金属离子恰好完全沉淀时增加的质量就是OH-的质量,其物质的量就等于Mg2+、Al3+时失去的电子的物质的量。根据等量关系可得。n(NO)= 1.792L÷22.4L/mol=0.08mol.所以n(e-)="0.08mol×3=0.24mol." 故形成沉淀的质量为3.92g+0.24mol×17g/mol=8.00g。
<4.242×10-5。需要的OH-的浓度越小,越容易形成沉淀。因此首先形成的是Al(OH)3沉淀。(4)装置B中盛放饱和NaCl溶液,该装置的主要作用是除去氯气中杂质气体HCl,同时减小氯气的溶解。由于无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,所以在F中试剂的作用是吸收水蒸气,防止无水AlCl3水解。用干燥管装填碱石灰也可起到F和G的作用。⑸Mg、Cu与硝酸发生反应变为Mg2+、Al3+时失去的电子的物质的量与HNO3得到电子的物质的量相等。而当向反应后的溶液中加入NaOH溶液金属离子恰好完全沉淀时增加的质量就是OH-的质量,其物质的量就等于Mg2+、Al3+时失去的电子的物质的量。根据等量关系可得。n(NO)= 1.792L÷22.4L/mol=0.08mol.所以n(e-)="0.08mol×3=0.24mol." 故形成沉淀的质量为3.92g+0.24mol×17g/mol=8.00g。

2013年底,上海青浦发生一家三口误食亚硝酸盐造成两男孩身亡的惨剧。常见的亚硝酸盐主要是亚硝酸钠(NaNO2),它是一种白色不透明晶体,虽然形状很像食盐,而且有咸味,但有毒。亚硝酸钠和氯化钠的部分资料如下表:
| | 亚硝酸钠(NaNO2) | 氯化钠(NaCl) |
| 水溶性 | 易溶,溶液呈弱碱性 | 易溶,溶液呈中性 |
| 熔点 | 271℃ | 801℃ |
| 沸点 | 320℃会分解 | 1413℃ |
| 跟稀盐酸作用 | 有红棕色的NO2气体放出 | 无反应 |
(1)氮元素最外层电子排布式为________,氮原子核外电子共占据了___个轨道。亚硝酸钠中各元素原子半径由大到小依次为_________,亚硝酸的电离方程式为:_______________________。
(2)亚硝酸盐中毒是因为亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,即血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象.美蓝是亚硝酸盐中毒后的有效解毒剂.下列说法不正确的是( )
A.高铁血红蛋白的还原性比亚硝酸盐弱
B.药品美蓝应具有还原性
C.中毒时亚硝酸盐发生还原反应
D.解毒时高铁血红蛋白被还原
(3)NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须处理后才能排放。处理方法之一:在酸性条件下, NaNO2与KI的物质的量为1:1时恰好完全反应,且I-被氧化为I2,此时产物中含氮的物质(A)为________(填化学式)。若利用上述方法制A,现有两种操作步骤:①先将废水酸化后再加KI;②先将KI酸化后再加入废水。哪种方法较好?____(填序号。假设废水中其它物质不反应)
(4)如要鉴别亚硝酸钠和氯化钠固体,下列方法不可行的是
A.观察并比较它们在水中的溶解速度 B.测定它们各自的熔点
C.在它们的水溶液中滴加甲基橙 D.在酸性条件下加入KI淀粉试液
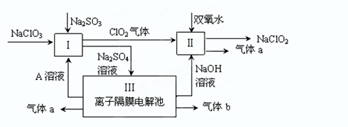
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
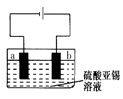
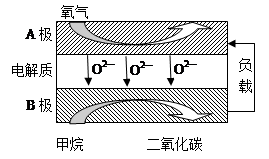
(2)目前已开发出用电解法制取ClO2的新工艺。
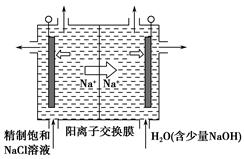
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:____________________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________;处理100 m3这种污水,至少需要ClO2________mol。
 Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。 Cl2↑+ Cu d.3Cl2 + 2Fe
Cl2↑+ Cu d.3Cl2 + 2Fe 2FeCl3
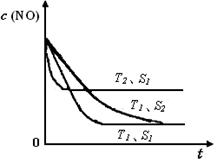
2FeCl3 2CO2(g) +N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2CO2(g) +N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。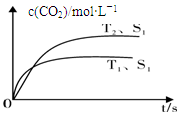
 Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为 。
Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为 。
 2N2(g)+3H2O(g) ΔH < 0
2N2(g)+3H2O(g) ΔH < 0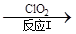 NO2
NO2 N2
N2