题目内容
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。
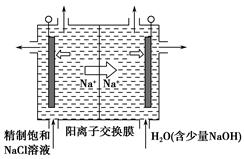
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO2的示意图。则阳极产生ClO2的电极反应式为________________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:____________________________________________。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,产物中有两种气体生成,其离子反应方程式为________;处理100 m3这种污水,至少需要ClO2________mol。
(1)①B ②0.1 (2)①Cl--5e-+2H2O=ClO2↑+4H+
②0.01 在阴极上发生反应2H++2e-=H2↑,H+浓度减小,使得H2O??
OH-+H+的平衡向右移动,OH-浓度增大,pH增大
(3)2ClO2+2CN-=N2↑+2CO2↑+2Cl- 50a/13
解析

练习册系列答案
相关题目
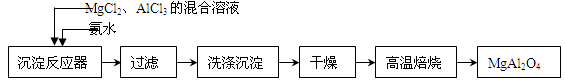
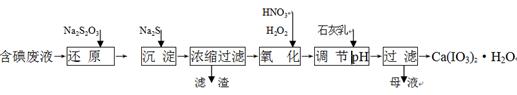
工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Pb(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 8.0 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.8 | 9.8 |
请回答下列问题:
(1)酸浸前将碳酸锰矿粉碎的作用是_________________________________。
(2)酸浸后的溶液中含有Mn2+、SO42-,另含有少量Fe2+、Fe3+、Al3+、Cu2+、Pb2+等,其除杂过程如下:
①加入MnO2将Fe2+氧化,其反应的离子方程式为___________________________________;
②加入CaO将溶液的pH调到5.2~6.0,其主要目的是_____________________________;
③加入BaS,除去Cu2+、Pb2+后,再加入NaF溶液,除去________。
(3)从溶液A中回收的主要物质是________,该物质常用做化肥。
(4)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应的化学方程式:______________________________________。
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。

①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式: 。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因 。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含
CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为 。
下列变化中起氧化作用和还原作用的元素不是同一种元素的是( )
| A.在400 ℃左右且有催化剂存在的条件下,用氨气把一氧化氮还原为氮气 |
| B.工业上用稀硫酸和氧气与单质铜反应制取硫酸铜 |
| C.工业上用石灰乳和氯气制备漂白粉 |
| D.实验室用氯酸钾和浓盐酸制取氯气 |
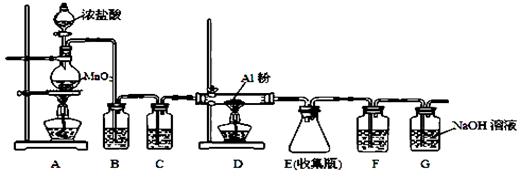
 ClO2↑+___________________(没有配平)
ClO2↑+___________________(没有配平)