题目内容
 M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:(1)元素Q的名称为
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为
(3)M、O电负性大小顺序是
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为
(5)该晶胞的边长为a×10-10cm,则距离最近的M、N离子间的距离为
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题
分析:M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则M为氧元素;N的焰色反应呈黄色,则N为Na;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质,可推知O为Cl、Q为Mn;P是一种金属元素,其基态原子中有6个未成对电子,核外电子排布为1s22s22p63s23p63d54s1,则P为Cr,据此解答.
解答:
解:M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,则M为氧元素;N的焰色反应呈黄色,则N为Na;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质,可推知O为Cl、Q为Mn;P是一种金属元素,其基态原子中有6个未成对电子,核外电子排布为1s22s22p63s23p63d54s1,则P为Cr,
(1)由上述分析可知,元素Q为锰,P是一种金属元素,其基态原子中有6个未成对电子,处于第四周期,核外电子排布为1s22s22p63s23p63d54s1,价层电子排布式为3d54s1,
故答案为:锰;3d54s1;
(2)HF分子间存在氢键,而HCl分子间无氢键,故HCl的沸点比HF的低
故答案为:HF分子间存在氢键,而HCl分子间无氢键;
(3)O、Cl元素形成的氧化物中Cl元素表现正化合价,故O原子对键合电子的吸引力更强,故电负性O>Cl,Cl的最高价含氧酸根为ClO4-,Cl原子孤电子对=
=0,价层电子对数为4,故其空间构型为 正四面体,其中心原子的杂化类型为sp3,
故答案为:O>Cl;正四面体;sp3;
(4)晶胞中Na为晶胞内部,晶胞中含有8个Na原子,O原子位于顶点与面心,晶胞中含有O原子数目为8×
+6×
=4,故该晶胞的化学式为Na2O,以晶胞中上面心M离子为研究对象,晶胞中没个M周围最近的N离子有8个,M离子配位数为8,该晶体类型为离子晶体,
故答案为:Na2O;8;离子晶体;
(5)N离子与周围4个M离子形成正四面体结构,晶胞的边长为a×10-10cm,则正四面体中2个M离子之间的距离=a×10-10cm×
×
,令M、N离子间的距离为x cm,则x2+x2-2x2cos109°28′=(a×10-10×
×
)2,解得x=
×10-10,
故答案为:
×10-10.
(1)由上述分析可知,元素Q为锰,P是一种金属元素,其基态原子中有6个未成对电子,处于第四周期,核外电子排布为1s22s22p63s23p63d54s1,价层电子排布式为3d54s1,
故答案为:锰;3d54s1;
(2)HF分子间存在氢键,而HCl分子间无氢键,故HCl的沸点比HF的低
故答案为:HF分子间存在氢键,而HCl分子间无氢键;
(3)O、Cl元素形成的氧化物中Cl元素表现正化合价,故O原子对键合电子的吸引力更强,故电负性O>Cl,Cl的最高价含氧酸根为ClO4-,Cl原子孤电子对=
| 7+1-2×4 |
| 2 |
故答案为:O>Cl;正四面体;sp3;
(4)晶胞中Na为晶胞内部,晶胞中含有8个Na原子,O原子位于顶点与面心,晶胞中含有O原子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:Na2O;8;离子晶体;
(5)N离子与周围4个M离子形成正四面体结构,晶胞的边长为a×10-10cm,则正四面体中2个M离子之间的距离=a×10-10cm×
| 2 |
| 1 |
| 2 |
| 2 |
| 1 |
| 2 |
| a | ||
2
|
故答案为:
| a | ||
2
|
点评:本题是对物质结构的考查,涉及核外电子排布、电负性、分子结构、杂化轨道、晶胞结构与计算等,(5)为易错点、难点,需要学生具有一定空间想象及数学计算能力,难点中等.

练习册系列答案
相关题目
白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4则60mol CuSO4能氧化白磷的物质的量是( )
| A、3mol | B、6mol |
| C、11mol | D、12mol |
下列说法正确的是( )
| A、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
| B、油脂都不能使溴的四氯化碳溶液褪色 |
| C、石油分馏、煤的干馏均为物理变化 |
| D、提纯鸡蛋白中的蛋白质时,可向鸡蛋清溶液中加入浓硫酸铵溶液,然后将所得沉淀滤出,经洗涤即得到较纯净的蛋白质 |
下列有关化学用语表示正确的是( )
| A、丙烯醛的结构简式:CH2CHCHO | ||
B、中子数为16的硫离子:
| ||
| C、硫酸氢钠熔融时的电离方程式:NaHSO4═Na++HSO4- | ||
D、NH4Br的电子式: |
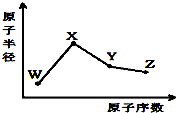 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强.下列说法正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高正价和最低负价之和为0;Z的非金属性在同周期元素中最强.下列说法正确的是( )| A、对应气态氢化物的稳定性:Y>Z |
| B、化合物XZW既含离子键也含共价键 |
| C、对应简单离子半径:W>X |
| D、Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |

 常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.
常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.