题目内容
下列有关化学用语表示正确的是( )
| A、丙烯醛的结构简式:CH2CHCHO | ||
B、中子数为16的硫离子:
| ||
| C、硫酸氢钠熔融时的电离方程式:NaHSO4═Na++HSO4- | ||
D、NH4Br的电子式: |
考点:结构简式,电子式,电离方程式的书写
专题:化学用语专题
分析:A.丙烯醛中含有碳碳双键,其结构简式中没有标出碳碳双键;
B.硫离子带有2个单位的负电荷;
C.熔融硫酸氢钠能够电离出钠离子和硫酸氢根离子;
D.溴离子最外层达到8电子稳定结构,没有标出其最外层电子.
B.硫离子带有2个单位的负电荷;
C.熔融硫酸氢钠能够电离出钠离子和硫酸氢根离子;
D.溴离子最外层达到8电子稳定结构,没有标出其最外层电子.
解答:
解:A.丙烯醛含有碳碳双键,所以丙烯醛正确的结构简式为:CH2=CHCHO,故A错误;
B.硫元素的核电荷数为16,中子数为16的硫离子的质量数为32,带有两个单位负电荷,该硫离子可以表示为:1632S2-,故B错误;
C.硫酸氢钠熔融时电离出钠离子和硫酸氢根离子,硫酸氢钠的电离方程式为:NaHSO4═Na++HSO4-,故C正确;
D.溴化铵为离子化合物,其电子式需要标出所有原子的最外层电子,溴化铵正确的电子式为: ,故D错误;
,故D错误;
故选C.
B.硫元素的核电荷数为16,中子数为16的硫离子的质量数为32,带有两个单位负电荷,该硫离子可以表示为:1632S2-,故B错误;
C.硫酸氢钠熔融时电离出钠离子和硫酸氢根离子,硫酸氢钠的电离方程式为:NaHSO4═Na++HSO4-,故C正确;
D.溴化铵为离子化合物,其电子式需要标出所有原子的最外层电子,溴化铵正确的电子式为:
 ,故D错误;
,故D错误;故选C.
点评:本题考查了电子式、结构简式、电离方程式、离子符号等化学用语的表示方法判断,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,选项D为易错点,注意离子化合物中阴离子需要标出最外层电子.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
用如图装置进行相应实验,不能达到实验目的是( )


| A、图1所示装置可制备氢氧化亚铁 |
| B、图2所示装置可电解食盐水制氯气和氢气 |
| C、图3所示装置可验证氨气极易溶于水 |
| D、图4所示装置与操作可除去苯中的苯酚 |
下列反应的离子方程式书写正确的是( )
| A、NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| B、向FeBr2溶液中滴加足量的氯水:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
| C、向40mL、8mol/L的硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| D、Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ |
下列装置或操作能达到所注明的实验能达到实验目的是( )


| A、①② | B、③④ | C、①③ | D、②④ |
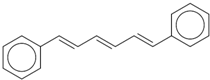 美国马丁?卡普拉等三位科学家因“在开发多尺度复杂化学系统模型”方面所做的贡献,获得了2013年诺贝尔化学奖.他们模拟出了1,6-二苯基-1,3,5-己三烯的分子模型,其结构简式如图所示.下列说法正确的是( )
美国马丁?卡普拉等三位科学家因“在开发多尺度复杂化学系统模型”方面所做的贡献,获得了2013年诺贝尔化学奖.他们模拟出了1,6-二苯基-1,3,5-己三烯的分子模型,其结构简式如图所示.下列说法正确的是( )| A、该有机物属于芳香烃,与苯互为同系物 |
| B、该有机物的分子式为C18H18 |
| C、1mol该有机物在常温下最多能与9mol Br2发生加成反应 |
| D、该有机物可以发生氧化反应、取代反应、加成反应 |
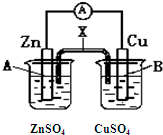 某电化学装置如图所示,下列说法正确的是( )
某电化学装置如图所示,下列说法正确的是( )| A、若X是盐桥,则电子由B电极经外电路流向A电极 |
| B、若X是盐桥,取出X电流表指针仍然偏转 |
| C、若X是锌条,则A电极的质量会减少 |
| D、若X是铜条,则A电极的电极反应式是:Zn2++2e-=Zn |
下列离子方程式表达正确的是( )
| A、碘化亚铁溶液中通入少量氯气:Cl2+2Fe2+═2Fe3++2Cl- |
| B、向1mol/L 0.1L的明矾溶液中加入0.5mol/L 0.2L的Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| C、将蛋壳浸泡到醋酸中:CO32-+2CH3COOH═2CH3COO-+CO2↑+H2O |
| D、将过氧化钠与水反应:2O22-+2H2O═O2+4OH- |
对于反应aA+bB=dD+eE,该化学反应速率定义为v=
=
=
=
.式中v(X)指物质X=(X=A,B,D,E)的反应速率,a、b、d、e是化学计量数.298k时,测得溶液中的反应H2O2+2HI═2H2O+I2在不同浓度时化学反应速率v见下表:以下说法正确的是( )
| v(A) |
| a |
| v(B) |
| b |
| v(D) |
| d |
| v(E) |
| e |
| 实验编号 | 1 | 2 | 3 | 4 |
| c(HI)/mol?L-1 | 0.100 | 0.200 | 0.300 | 0.100 |
| c(H2O2)/mol?L-1 | 0.100 | 0.100 | 0.100 | 0.200 |
| v/mol?L-1?s-1 | 0.00760 | 0.0153 | 0.0227 | 0.0151 |
| A、实验1、2中,v(H2O2)相等 |
| B、将浓度均为0.200mol?L-1 H2O2和HI溶液等体积混合,反应开始时v=0.0304mol?L-1?s-1 |
| C、v与“HI和H2O2浓度的乘积”的比值为常数 |
| D、实验4,反应5秒后H2O2浓度减少了0.0755mol?L-1 |
 M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题: