题目内容
13.A、B、C、D、E五种元素,前四种短周期元素在周期表中的相对位置如图所示,酸雨的形成与D元素密切相关,E2+的核外电子数比D原子的核外电子数多2,下列说法正确的是( )| A | B | C |
| D |
| A. | 原子半径由大到小的顺序为E>B>D>C>A | |
| B. | 元素D可形成多种酸,它们的酸根均能促进水的电离 | |
| C. | EB2中存在离子键与非极性共价键 | |
| D. | C位于周期表中第二周期第ⅦA族,其最高正价为+7 |
分析 A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D至少位于第三周期,酸雨的形成与D元素密切相关,则D为S元素,则A、B、C分别是N、O、F元素;E2+的核外电子数比D原子的核外电子数多2,D原子的核外电子总数16,则E质子数是20,为Ca元素,据此进行解答.
解答 解:A、B、C、D、E五种元素,前四种短周期元素在周期表中的位置如图所示,D至少位于第三周期,酸雨的形成与D元素密切相关,则D为S元素,则A、B、C分别是N、O、F元素;E2+的核外电子数比D原子的核外电子数多2,D原子的核外电子总数16,则E质子数是20,为Ca元素,
A.电子层数越多原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,同主族元素从上到下原子半径逐渐增大,所以原子半径大小为:E>D>A>B>C,故A错误;
B.D为S元素,形成的酸与亚硫酸、硫酸,亚硫酸根离子能够促进水的电离,但硫酸根离子不能促进水的电离,故B错误;
C.EB2为CaO2,该化合物为离子化合物,含有离子键,且过氧根离子中还含有非极性共价键,故C正确;
D.C为F元素,原子序数为7,位于周期表中第二周期第ⅦA族,但F元素没有正价,故D错误;
故选C.
点评 本题考查元素周期表和元素周期律的综合应用,侧重考查基本概念、元素推断、元素周期律等知识点,正确判断元素是解本题关键,注意元素周期律的灵活运用,易错选项是B.

练习册系列答案
相关题目
2.硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质.用硼泥生产氢氧化镁的工艺流程如图所示,已知生成氢氧化物沉淀的pH见表.下列说法正确的是( )


| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| A. | 反应①中H2O2主要用于还原剂 | |
| B. | 滤渣1和滤渣2都不能溶于NaOH溶液 | |
| C. | 反应③发生主要反应的离子方程式:H++OH-═H2O | |
| D. | 以滤渣2为原料可以制备涂料铁红 |
4.镍氢电池(NiMH)目前己经成为混合动力汽车的一种主要电池类型.NiMH中的M 示储氢金属或合金,该电池在充电过程中的总反应方程式是:Ni(OH)2+M═NiOOH+MH 下列说法正确的是( )
| A. | 放电过程中,正极的电极反应式为NiOOH+H2O+e-═Ni(OH)2+OH- | |
| B. | 放电时,电子由负极→正极→电解质溶液→负极,形成闭合回路 | |
| C. | 充电时,阴极附近溶液pH 降低 | |
| D. | 充电过程中,OH-从阳极向阴极迁移 |
1.某有机物的球棍模型如图所示,下列有关说法中不正确的是( )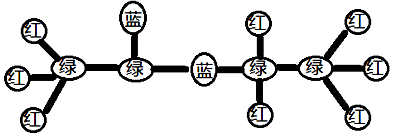

| A. | 该有机物的同分异构体中能够与碳酸氢钠溶液反应产生气体的不同结构有两种 | |
| B. | 实验室制备该有机物的反应类型与乙烯和溴的四氯化碳溶液反应的反应类型相同 | |
| C. | 1mol该有机物与足量的NaOH溶液反应,消耗的氢氧化钠的物质的量为1mol | |
| D. | 当该有机物与丙烷的总物质的量不变时,无论二者以何种比例混合,完全燃烧的耗氧量为定值 |
8.短周期主族元素W、X、Y、Z的原子序数依次增大,W2-和X+的电子层结构相同,X的原子半径是短周期主族元素原子中最大的,W与Y同族.下列说法正确的是( )
| A. | W、X形成的化合物只含有离子键 | B. | 原子半径:Y>Z>W | ||
| C. | 还原性:W2->Y2- | D. | 氧化物的水化物酸性:Y<Z |
18.将0.1mol天然碱(2Na2CO3•NaHCO3•2H2O)溶于水配成1L溶液,下列关于该溶液的说法正确的是( )
| A. | c(CO32-)+c(HCO3-)=0.3mol•L-1 | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H-) | ||
| C. | c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | D. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
1.Li-FeS2热激活电池以固体KCl、LiCl为电解质,放电总反应为:FeS2+4Li=Fe+2Li2S,下列说法不正确的是( )
| A. | 负极反应式为:Li-e-=Li+ | |
| B. | 正极反应式为:FeS2+4e-=Fe+2S2- | |
| C. | 电池放电时K+向正极移动 | |
| D. | 可用KCl、LiCl的水溶液做电解质溶液 |
20.下列各组中互为同分异构体的是( )
| A. | ${\;}_{19}^{40}$K 与${\;}_{19}^{39}$K | B. | T2O与H2O | ||
| C. | CH3CH2CH2CH3与 | D. | CH3CH3与CH3CH3CH3 |
