题目内容
20.下列各组中互为同分异构体的是( )| A. | ${\;}_{19}^{40}$K 与${\;}_{19}^{39}$K | B. | T2O与H2O | ||
| C. | CH3CH2CH2CH3与 | D. | CH3CH3与CH3CH3CH3 |
分析 同分异构体是指分子式相同,但结构不同的化合物.
解答 解:A.${\;}_{19}^{40}$K 与${\;}_{19}^{39}$K是质子数相同,中子数不同的原子,互称同位素,不是同分异构体,故A错误;
B.T2O与H2O结构相同,为不同核素形成的化合物,不是同分异构体,故B错误;
C.CH3CH2CH2CH3与 分子式相同,结构不同,互为同分异构体,故C正确;
分子式相同,结构不同,互为同分异构体,故C正确;
D.CH3CH3与CH3CH3CH3结构相似,分子间相差1个CH2原子团,二者互为同系物,不是同分异构体,故D错误.
故选C.
点评 本题考查了有机化合物的同分异构体的判断和理解,掌握概念实质是解题关键,题目较简单.

练习册系列答案
相关题目
13.A、B、C、D、E五种元素,前四种短周期元素在周期表中的相对位置如图所示,酸雨的形成与D元素密切相关,E2+的核外电子数比D原子的核外电子数多2,下列说法正确的是( )
| A | B | C |
| D |
| A. | 原子半径由大到小的顺序为E>B>D>C>A | |
| B. | 元素D可形成多种酸,它们的酸根均能促进水的电离 | |
| C. | EB2中存在离子键与非极性共价键 | |
| D. | C位于周期表中第二周期第ⅦA族,其最高正价为+7 |
12. 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )| A. | 溶液中H+的移动方向由A极到B极 | |
| B. | 电池总反应方程式为:2SO2+O2+2H2O=2H2SO4 | |
| C. | 正极电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol |
8.钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
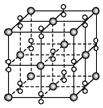

| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 每个晶胞含有4个Ba2+和4个O2- | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有12个 |
15.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,某微生物燃料电池的工作原理如图所示,下列说法正确的是( )


| A. | 电子从b流出,经外电路流向a | |
| B. | HS在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-═SO42-+9H+ | |
| C. | 如果将反应物直接燃烧,能量的利用率不会变化 | |
| D. | 若该电池电路中有0.4mol电子发生转移,则有0.5mol H+通过质子交换膜 |
12.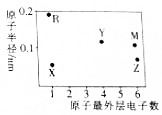 X、Y、Z、M、R为五种短周期主族元素,其原子半径和最外层电子数之间的关系如图所示.下列说法正确的是( )
X、Y、Z、M、R为五种短周期主族元素,其原子半径和最外层电子数之间的关系如图所示.下列说法正确的是( )
 X、Y、Z、M、R为五种短周期主族元素,其原子半径和最外层电子数之间的关系如图所示.下列说法正确的是( )
X、Y、Z、M、R为五种短周期主族元素,其原子半径和最外层电子数之间的关系如图所示.下列说法正确的是( )| A. | 五种元素位于同一周期 | |
| B. | 简单离子半径:M<R | |
| C. | Y、Z形成的常见化合物中存在离子键 | |
| D. | 气态氢化物的稳定性、沸点均有Z>M |