题目内容
1.Li-FeS2热激活电池以固体KCl、LiCl为电解质,放电总反应为:FeS2+4Li=Fe+2Li2S,下列说法不正确的是( )| A. | 负极反应式为:Li-e-=Li+ | |
| B. | 正极反应式为:FeS2+4e-=Fe+2S2- | |
| C. | 电池放电时K+向正极移动 | |
| D. | 可用KCl、LiCl的水溶液做电解质溶液 |
分析 A、负极锂发生氧化反应;
B、正极是FeS2发生还原反应,生成单质铁和-2价的硫离子;
C、原电池中阳离子向正极移动;
D、金属锂可以和水之间发生反应.
解答 解:A、负极锂发生氧化反应,电极反应式为:Li-e-=Li+,故A正确;
B、正极是FeS2发生还原反应,生成单质铁和-2价的硫离子,所以电极反应式为:正极反应式为:FeS2+4e-=Fe+2S2-,故B正确;
C、原电池中阳离子向正极移动,所以钾离子向正极移动,故C正确;
D、金属锂可以和水之间发生反应,所以该电池不能用某物质的水溶液作为电解质溶液,故D错误.
故选D.
点评 本题考查了氧化还原反应、原电池原理,侧重于基础知识的考查,注意根据氧化还原反应中元素化合价的变化分析,题目难度不大.

练习册系列答案
相关题目
11.酚醛树脂M结构如图,下列说法不正确的是( )


| A. | M是合成高分子化合物 | B. | n是一个定值 | ||
| C. | 可用苯酚和甲醛合成M | D. | 合成M的反应缩聚反应 |
13.A、B、C、D、E五种元素,前四种短周期元素在周期表中的相对位置如图所示,酸雨的形成与D元素密切相关,E2+的核外电子数比D原子的核外电子数多2,下列说法正确的是( )
| A | B | C |
| D |
| A. | 原子半径由大到小的顺序为E>B>D>C>A | |
| B. | 元素D可形成多种酸,它们的酸根均能促进水的电离 | |
| C. | EB2中存在离子键与非极性共价键 | |
| D. | C位于周期表中第二周期第ⅦA族,其最高正价为+7 |
9.X、Y、Z、R、W 是原子序数依次增大的五种短周期元素.Y 和 R 同主族,可组成共价化合物 RY2,Y 和 Z 最外层电子数之和与 W 的最外层电子数相同,25℃时,0.1mol/L X 和 W 形成化合物的水溶液 pH=1.下列说法正确的是( )
| A. | 简单离子的半径:Z>R>W>Y | |
| B. | Y、Z、W 三种元素组成的化合物的水溶液可能显碱性 | |
| C. | Z 与 Y、Z 与 W 形成的化合物的化学键完全相同 | |
| D. | WY2、Y3 等可作为新的自来水消毒剂替代 W2,主要原因是 WY2、Y3 的氧化性比 W2 更强 |
16.X、Y、Z、W四种物质在一定条件下具有如图所示的转化关系,下列判断正确的是( )


| A. | 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl3 | |
| B. | 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2 | |
| C. | 若图中反应均为非氧化还原反应,当W为一元强酸时,则X可能是NH3 | |
| D. | 若图中反应均为非氧化还原反应,当W为一元强碱时,则X可能是NaAlO2 |
12. 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
 随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具有重要意义.有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料.下列说法不正确的是( )| A. | 溶液中H+的移动方向由A极到B极 | |
| B. | 电池总反应方程式为:2SO2+O2+2H2O=2H2SO4 | |
| C. | 正极电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 当有0.25mol SO2被吸收时,通过H+交换膜的H+的物质的量为0.5mol |
8.钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如图所示,有关说法正确的是( )
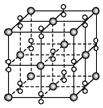

| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 每个晶胞含有4个Ba2+和4个O2- | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有12个 |
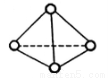 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。