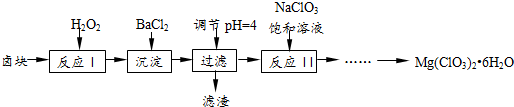
题目内容
3.将3.00gNa2CO3和NaCl的混合物制成250ml的水溶液,取此溶液25ml与21.00m1 0.1050mol•L-1盐酸溶液完全反应(以甲基橙为指标剂),求混合物中氯化钠的百分含量.分析 混合物中只有碳酸钠与盐酸反应,根据n=cV可计算出25mL样品溶液消耗HCl的物质的量,然后计算出250mL样品溶液完全反应消耗HCl的物质的量,再结合反应方程式计算出碳酸钠的物质的量,根据m=nM计算出碳酸钠的质量,从而可计算出混合物中氯化钠的质量,最后计算出混合物中氯化钠的质量分数.
解答 解:21.00m1 0.1050mol•L-1盐酸溶液中含有HCl的物质的量为:0.1050mol•L-1×0.021L=0.002205mol,则250mL碳酸钠、氯化钠溶液与盐酸完全反应消耗HCl的物质的量为:0.002205mol×$\frac{250mL}{25mL}$=0.02205mol,
根据反应Na2CO3+2HCl=2NaCl+CO2↑+H2O可知,原混合中碳酸钠的物质的量为:0.02205mol×$\frac{1}{2}$=0.011025mol,其质量为:106g/mol×0.011025mol=1.16865g,
则原混合物中含有NaCl的质量为:3.00g-1.16865g=1.83135g,
所以混合物中氯化钠的质量分数为:$\frac{1.83135}{3.00g}$×100%=61.045%,
答:混合物中氯化钠的质量分数为61.045%.
点评 本题考查了混合物反应的计算,题目难度不大,明确发生反应的原理为解答关键,注意掌握质量分数的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
11.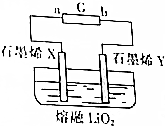 据英国《金融时报》网站最近报道,英国科学家研制出一种超容量的锂电池.其简易电池工作原理如图所示.X、Y是用石墨烯制成的渗透性极好的“蓬松”电极,其中石墨烯X极附着锂.该电池的工作原理是Li(s)+O2(g)$?_{充电}^{放电}$LiO2(s).下列说法不正确的是( )
据英国《金融时报》网站最近报道,英国科学家研制出一种超容量的锂电池.其简易电池工作原理如图所示.X、Y是用石墨烯制成的渗透性极好的“蓬松”电极,其中石墨烯X极附着锂.该电池的工作原理是Li(s)+O2(g)$?_{充电}^{放电}$LiO2(s).下列说法不正确的是( )
 据英国《金融时报》网站最近报道,英国科学家研制出一种超容量的锂电池.其简易电池工作原理如图所示.X、Y是用石墨烯制成的渗透性极好的“蓬松”电极,其中石墨烯X极附着锂.该电池的工作原理是Li(s)+O2(g)$?_{充电}^{放电}$LiO2(s).下列说法不正确的是( )
据英国《金融时报》网站最近报道,英国科学家研制出一种超容量的锂电池.其简易电池工作原理如图所示.X、Y是用石墨烯制成的渗透性极好的“蓬松”电极,其中石墨烯X极附着锂.该电池的工作原理是Li(s)+O2(g)$?_{充电}^{放电}$LiO2(s).下列说法不正确的是( )| A. | 充电过程,电源G的b极为负极 | |
| B. | 放电过程,Y极发生还原反应 | |
| C. | 放电过程,X极的电极反应式为Li-e-+O2-═LiO2 | |
| D. | 充电过程,每转移2 mol电子,Y极放出44.8L(标准状况)O2 |
15.在一定条件下的密闭容器中投入4mol A和n mol的B,发生如下反应4A+5B?4C+6D.达到平衡时,测得A的转化率大于B的转化率,则n的取值范围正确的是( )
| A. | n=5 | B. | n<5 | C. | n>5 | D. | 无法判断 |
5.电解100mL含c(H+)=0.30mol•L-1的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是( )
| A. | 0.10 mol•L-1AgNO3 | B. | 0.20 mol•L-1Zn(NO3)2 | ||
| C. | 0.20 mol•L-1Cu(NO3)2 | D. | 0.20 mol•L-1Pb(NO3)2 |

 ;
; +3NaOH $→_{高压}^{高温}$
+3NaOH $→_{高压}^{高温}$ +NaCl+2H2O;
+NaCl+2H2O; ;
; (任写一种结构简式).
(任写一种结构简式).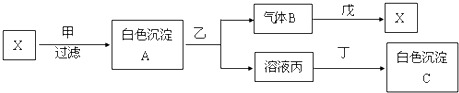
 ;
;