题目内容
2.中国研究人员成功开发出一款锂-氮可充电电池,该电池系统由锂电池阳极、可传递Li+的醚类电解质、碳布阴极组成,其原理为6Li+N2═2Li3N.以下说法合理的是( )| A. | 放电时Li+由正极移向负极 | |
| B. | 也可以用氯化锂水溶液做电解质传递Li+ | |
| C. | 放电时正极反应:6Li++N2+6e-═2Li3N | |
| D. | 充电是固氮过程 |
分析 据总反应6Li+N2═2Li3N可知:放电时锂失电子作负极,负极上电极反应式为6Li-6e-═6Li+,Li+移向正极,氮气在正极得电子发生还原反应,电极反应式为6Li++N2+6e-═2Li3N,充电是放电的逆过程,据此解答.
解答 解:A.放电时,负极Li失电子产生Li+,阳离子向正极移动,则Li+向由负极向正极移动,故A错误;
B.因为锂很活泼能与水发生反应,所以不可以用氯化锂水溶液做电解质,故B错误;
C.氮气在正极得电子发生还原反应,电极反应式为6Li++N2+6e-═2Li3N,故C正确;
D.将游离态的氮转化成化合态的氮是氮的固定,则放电才是氮的固定,故D错误;
故选C.
点评 本题考查了原电池和电解池的工作原理,明确原电池负极上得失电子及电极反应式是解本题关键,题目难度中等,注意把握金属锂的活泼性.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
12. 石墨烯锂-硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,该电池结构如图所示,电池反应为2Li+nS$?_{充电}^{放电}$Li2Sn.有关该电池的说法正确的是( )
石墨烯锂-硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,该电池结构如图所示,电池反应为2Li+nS$?_{充电}^{放电}$Li2Sn.有关该电池的说法正确的是( )
 石墨烯锂-硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,该电池结构如图所示,电池反应为2Li+nS$?_{充电}^{放电}$Li2Sn.有关该电池的说法正确的是( )
石墨烯锂-硫电池是一种高容量、长循环寿命、低成本及环境友好的新型二次电池,该电池结构如图所示,电池反应为2Li+nS$?_{充电}^{放电}$Li2Sn.有关该电池的说法正确的是( )| A. | 放电时,Li+向负极迁移 | |
| B. | 充电时,A电极连接电源的负极 | |
| C. | 充电时,每生成n mol S转移2n mol电子 | |
| D. | 放电时,正极上可发生反应2Li++2Li2S6+2e-═3Li2S4 |
13.锶有“金属味精”之称.以天青石(主要含有SrSO4和少量CaCO3. MgO杂质)生产氢氧化锶的工艺如图:
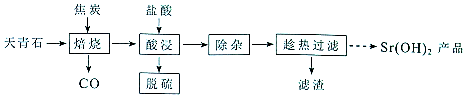
已知氢氧化锶在水中的溶解度:
(1)隔绝空气焙烧时SrSO4只被还原成SrS,化学方程式为SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑.
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12.
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=1.2×10-10.
②若pH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,导致氢氧化锶沉淀析出.
(3)“趁热过滤”的目的是防止温度降低氢氧化锶析出造成产品的损失,可使钙离子尽可能转化为Ca(OH)2.“滤渣”的主要成分为Mg(OH)2、Mg(OH)2.
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶或冷却结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCI3溶液吸收酸浸产生的气体,吸收时的氧化产物为S(填化学式):再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3.

已知氢氧化锶在水中的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12.
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=1.2×10-10.
②若pH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,导致氢氧化锶沉淀析出.
(3)“趁热过滤”的目的是防止温度降低氢氧化锶析出造成产品的损失,可使钙离子尽可能转化为Ca(OH)2.“滤渣”的主要成分为Mg(OH)2、Mg(OH)2.
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶或冷却结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCI3溶液吸收酸浸产生的气体,吸收时的氧化产物为S(填化学式):再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3.
10.短周期主族元索R、X、Y、M的原子序数依次增大,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍,原子序数R+X=Y.下列说法不正确的是( )
| A. | 简单的离子半径:M>X>Y | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | X、M的最高氧化物对应的水化物均为强酸 | |
| D. | 由R、X、Y、M四种元素只能组成一种盐 |
17.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 冷浓硝酸不能用铝制容器盛装 | |
| B. | 钠可从钴盐溶液中置换出钴单质 | |
| C. | 食盐中加入碘单质可以预防甲状腺肿大 | |
| D. | 光导纤维遇氢氧化钠溶液易“断路” |
7.化学与生产、生活及环境密切相关,下列有关说法正确的是( )
| A. | 工业上海水提镁涉及的一系列反应都是氧化还原反应 | |
| B. | 汽车尾气污染物中含有的氮氧化物,是汽油或柴油不完全燃烧造成的 | |
| C. | 江河入海口形成的三角洲与胶体聚沉有关 | |
| D. | 用于光缆通信的光导纤维和制作航天服的聚酯纤维都是新型无机非金属材料 |
14.下列化学工业所采取的措施中,能用勒夏特列原理解释的是( )
| A. | 合成氨工业:温度控制在500℃左右 | |
| B. | 接触法制硫酸:SO2在常压下催化氧化 | |
| C. | 侯氏制碱法:往母液中继续加入食盐和氨气 | |
| D. | 石油化工:将分馏得到的重油在高温下裂化 |
10.下列有关元素周期表的说法正确的是( )
| A. | 第IA的元素全部是金属元素 | |
| B. | 元素周期表有18个族 | |
| C. | 元素周期表含元素最多的族是第ⅢB族 | |
| D. | 短周期是指第一、二、三、四周期 |
11.无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧.上述中“结合力”实质是( )
| A. | 分子间作用力 | B. | 氢键 | C. | 非极性共价键 | D. | 极性共价键 |