题目内容
16.若用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )| A. | 1mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA | |
| B. | 锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4L,锌失去电子数为2NA | |
| C. | 常温常压下,20g D2O含有的原子总数为3NA | |
| D. | 标准状况下,44.8L NO与22.4L O2混合气体中分子总数小于2NA |
分析 A.BrCl与H2O完全反应生成氯化氢和次溴酸,反应中化合价没有发生变化;
B.生成1mol二氧化硫或1mol氢气都转移了2mol电子,据此计算转移电子数;
C.重水的摩尔质量为20g/mol,20g重水的物质的量为1mol,含有3mol原子;
D.部分二氧化氮转化成四氧化二氮,导致反应后分子数减少.
解答 解:A.BrCl与H2O完全反应生成氯化氢和次溴酸,该反应中没有化合价变化,不属于氧化还原反应,故A错误;
B.标准状况下22.4L气体的物质的量为1mol,由于硫酸变为二氧化硫或氢气的反应中,化合价变化都是2,则生成1mol混合气体转移了2mol电子,反应中锌失去电子数为2NA,故B正确;
C.20g重水的物质的量为:$\frac{20g}{20g/mol}$=1mol,1mol重水中含有3mol原子,含有的原子总数为3NA,故C正确;
D.标准状况下,44.8L NO的物质的量为2mol,22.4L O2的物质的量为1mol,二者恰好反应生成2mol二氧化氮,由于部分二氧化氮转化成四氧化二氮,则反应后气体的物质的量小于2mol,气体的分子总数小于2NA,故D正确;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;D为易错点,注意二氧化氮与四氧化二氮之间存在转化平衡.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
7.关于氧化还原反应的说法,正确的是( )
| A. | 物质失去的电子数越多,其还原性越强 | |
| B. | 物质所含元素化合价升高的反应叫还原反应 | |
| C. | 某元素由化合态变为游离态,则它一定被还原 | |
| D. | 置换反应一定属于氧化还原反应 |
4.下列说法中正确的是( )
| A. | 链状有机物C5H7Cl,其结构中肯定含一个碳碳双键 | |
| B. | C8H10是苯的同系物,它共有3中不同的结构 | |
| C. | 聚氯乙烯(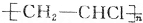 )的相对分子质量一定比聚乙烯( )的相对分子质量一定比聚乙烯( )的大34.5n )的大34.5n | |
| D. | 可用银氨溶液区别葡萄糖和果糖 |
11.短周期主族元素A、B、C、D、E的原子序数依次增大,其中只有C是金属元素,B是地壳中含量最多的元素,A是原子半径最小的元素,A与C的最外层电子数相同,C、D两元素原子的电子数之和为A、B两种元素原子的电子数之和的3倍.下列叙述正确的是( )
| A. | 元素的原子半径:A<B<C<D<E | |
| B. | 对应氢化物的热稳定性:D>E | |
| C. | B与C、B与D形成的化合物中化学键类型相同 | |
| D. | 五种元素中最高价氧化物对应的水化物酸性最强的是E |
3.下列各情况,在其中Fe片腐蚀最快的是( )


| A. | (2) | B. | (4) | C. | (3) | D. | (5) |
1.某有机物在氧气中充分燃烧,生成等物质的量的水和二氧化碳,则该有机物必须满足的条件是( )
| A. | 分子中的C、H、O的个数比为1:2:1 | B. | 分子中C、H个数比为1:2 | ||
| C. | 该有机物的相对分子质量为14 | D. | 该分子中肯定不含氧元素 |

 已知:2X(g)+Y(g)?a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答:
已知:2X(g)+Y(g)?a Z(g),在T1温度下,体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答: