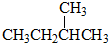题目内容
10.工业上常用氧化黄铁矿的方法制备硫酸亚铁:2FeS2+7O2+2H2O=2FeSO4+2H2SO4,下列说法正确的是( )| A. | FeS2既是氧化剂,又是还原剂 | |
| B. | FeSO4溶液保存过程中需加稀硫酸和铁粉,防止变质 | |
| C. | 每生产1molFeSO4,转移的电子数为28NA | |
| D. | 硫酸工业中煅烧黄铁矿,其氧化产物只有SO2 |
分析 A.依据反应中各元素化合价变化判断,氧化剂还原剂;
B.防止亚铁离子氧化,并抑制水解;
C.2FeS2+7O2+2H2O=2FeSO4+2H2SO4,氧气为氧化剂,依据7mol氧气参加反应转移28mol电子,据此计算;
D.黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4.
解答 解:A.依据方程式2FeS2+7O2+2H2O=2FeSO4+2H2SO4可知:反应中FeS2中铁元素化合价不变,硫元素化合价升高,所以FeS2是还原化剂,故A错误;
B.防止亚铁离子氧化,并抑制水解,则配制FeSO4溶液时,需加入少量铁粉和稀硫酸,故B正确;
C.2FeS2+7O2+2H2O=2FeSO4+2H2SO4,氧气为氧化剂,7mol氧气参加反应生成2mol硫酸亚铁转移28mol电子,则生成1mol硫酸亚铁转移14mol电子,故C错误;
D.黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4,反应中FeS2化合价都升高,所以SO2和Fe3O4都是氧化产物,故D错误;
故选:B.
点评 本题考查了氧化还原反应,准确判断反应各元素化合价变化及氧化还原反应得失电子守恒是解题关键,题目难度中等.

练习册系列答案
 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
20.我国古代有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4═Cu+FeSO4.下列有关说法不正确的是( )
| A. | 该反应属于置换反应 | |
| B. | 若铁粉过量,充分反应后溶液由蓝色变为棕黄色 | |
| C. | CuSO4具有氧化性 | |
| D. | 转移0.2mol电子,则固体质量增加了0.8g |
1.下列说法中错误的是( )
| A. | 不是所有的烷烃中都既有极性键,又有非极性键 | |
| B. | 所有的烯烃中都是既有极性键,又有非极性键 | |
| C. | 在CCl4中碳元素呈现+4价 | |
| D. | 有机化学反应只能发生在极性键上 |
18.《本草纲目》中的“石碱”条目下写道:“采蒿蓼之属,晒干烧灰,以水淋汁,久则凝淀如石,浣衣发面,亦去垢发面.”这里的“石碱”是指( )
| A. | KOH | B. | KAl(SO4)2 | C. | KHCO3 | D. | K2CO3 |
4.用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶,胶头滴管;
(2)滴定过程:
①盛装0.10mol/L的盐酸标准液应该使用酸滴定管;
②滴定时双眼应注意观察注意观察锥形瓶内溶液颜色的变化;
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低;
④装标准液之前,没有用标准液润洗滴定管,测定结果偏高;
(4)有关数据记录如下:
计算纯度:烧碱样品的纯度是80.8%(取两次实验所耗盐酸的平均值进行计算,不写计算过程)
(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶,胶头滴管;
(2)滴定过程:
①盛装0.10mol/L的盐酸标准液应该使用酸滴定管;
②滴定时双眼应注意观察注意观察锥形瓶内溶液颜色的变化;
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低;
④装标准液之前,没有用标准液润洗滴定管,测定结果偏高;
(4)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
11.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极得电子反应产物是Mn2O3(s) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
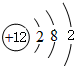 、
、 ,C的离子结构示意图
,C的离子结构示意图
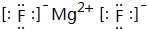 化学键类型为离子键.
化学键类型为离子键. 和
和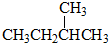
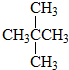 和
和