题目内容
9.同学们已经学习了同位素、同系物、同分异构体,你能区分这些概念吗?下面列出了几组物质,请用物质的组号填写下表.①
 和
和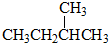
②
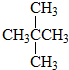 和
和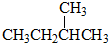
③CH4和CH3CH2CH3;
④金刚石和石墨:
⑤H、D、T;⑥16O、17O、18O;
⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);
⑧臭氧(O3)和氧气(O2).
| 类别 | 同位素 | 同素异形体 | 同系物 | 同分异构体 |
| 组号 |
分析 根据同位素、同系物、同素异形体、同分异构体的概念判断,同位素的对象是原子,是同种元素不同原子;同素异形体的对象是单质,即同种元素形成的不同单质;若化学式为分子式相同、结构不同的有机化合物,则为同分异构体;若是分子式不同结构相似的有机化合物,则为同系物.
解答 解:同位素的对象是原子,是同种元素不同原子;同素异形体的对象是单质,即同种元素形成的不同单质;若化学式为分子式相同、结构不同的有机化合物,则为同分异构体;若是分子式不同结构相似的有机化合物,则为同系物,所以①为同系物; ②为同分异构体;③为同系物;④为同素异形体;⑤为同位素;⑥为同位素;⑦为同分异构体;⑧为同素异形体,
故答案为:
| 类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
| 组号 | ⑤⑥ | ①③ | ④⑧ | ②⑦ |
点评 本题考查了同位素、同素异形体、同分异构体、同系物的判断方法,注意概念的把握,题目较简单.

练习册系列答案
相关题目
10.工业上常用氧化黄铁矿的方法制备硫酸亚铁:2FeS2+7O2+2H2O=2FeSO4+2H2SO4,下列说法正确的是( )
| A. | FeS2既是氧化剂,又是还原剂 | |
| B. | FeSO4溶液保存过程中需加稀硫酸和铁粉,防止变质 | |
| C. | 每生产1molFeSO4,转移的电子数为28NA | |
| D. | 硫酸工业中煅烧黄铁矿,其氧化产物只有SO2 |
17.下列原子或原子团不属于官能团的是( )
| A. | -CH3 | B. | -F | C. | -OH | D. |  |
4.下列物质的转化,不能通过一步反应完成的是( )
| A. | Na2CO3→Na2SiO3 | B. | SiO2→H2SiO3 | C. | Cu→CuSO4 | D. | SiO2→Si |
14.电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:答下列有关问题:
(1)预测周期表中电负性最大的元素应为F;估计钙元素的电负性的取值范围:0.8<X<1.2
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是同主族自上而下电负性降低.
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键,其理由是因为AlCl3中Cl与Al的电负性差值为1.5,小于1.7,则AlCl3的键为共价键.而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值也小于1.7,即AlBr3的键为共价键.
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是同主族自上而下电负性降低.
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AlBr3中形成的化学键的类型为共价键,其理由是因为AlCl3中Cl与Al的电负性差值为1.5,小于1.7,则AlCl3的键为共价键.而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值也小于1.7,即AlBr3的键为共价键.
18.碳、氮广泛的分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途.
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)该反应放出1591.2kJ的能量,则该反应每转移1mole-,可放出的热量为132.6kJ.
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
①实验Ⅰ中,前5min的反应速率v(H2O)=0.15mol•L-1•min-1.
②下列能判断实验Ⅱ已经达到平衡状态的是be.
a.混合气体的密度保持不变 b.容器内CO、H2O、CO2、H2的浓度比不再变化
c.容器内压强不再变化 d.容器中气体的平均相对分子质量不随时间而变化
e. v正(CO)=v逆(H2 O)
③若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如图1所示,b点v正>v逆(填“<”、“=”或“>”).
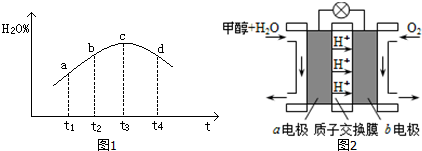
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇(CH3OH)-空气”形成的绿色燃料电池的工作原理示意图2,写出以石墨为电极的电池工作时负极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700°C的氮气流中反应制得:3SiO2(s)+6C(s)+2N2(g)?Si3N4(s)+6CO(g)该反应放出1591.2kJ的能量,则该反应每转移1mole-,可放出的热量为132.6kJ.
(2)某研究小组现将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| CO | H2O | CO | H2 | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |
②下列能判断实验Ⅱ已经达到平衡状态的是be.
a.混合气体的密度保持不变 b.容器内CO、H2O、CO2、H2的浓度比不再变化
c.容器内压强不再变化 d.容器中气体的平均相对分子质量不随时间而变化
e. v正(CO)=v逆(H2 O)
③若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如图1所示,b点v正>v逆(填“<”、“=”或“>”).

(3)利用CO与H2可直接合成甲醇,下图是由“甲醇(CH3OH)-空气”形成的绿色燃料电池的工作原理示意图2,写出以石墨为电极的电池工作时负极的电极反应式CH3OH-6e-+H2O=CO2+6H+.
19.下列说法,正确的是( )
| A. | 1H、D、T互为同位素 | B. | 金刚石、石墨、C60互为同分异构体 | ||
| C. | SO2和SO3互为同分异构体 | D. | 正丁烷和异丁烷互为同素异形体 |