题目内容
11.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极得电子反应产物是Mn2O3(s) | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
分析 根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),以此解答该题.
解答 解:A.根据总反应可知Zn失电子被氧化,为原电池的负极,故A正确;
B.MnO2得电子原电池的正极反应物,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),所以电池正极得电子反应产物是Mn2O3(s),故B正确;
C.原电池中,电子由负极经外电路流向正极,电流由正极通过外电路流向负极,故C错误;
D.负极反应为Zn-2e-+2OH-═Zn(OH)2,外电路中每通过O.2mol电子,消耗的Zn的物质的量为0.1mol,质量为0.1mol×65g/mol=6.5g,故D正确.
故选C.
点评 本题考查化学电源的工作原理,侧重于学生的分析能力和综合运用电化学知识的考查,题目难度不大,注意电极反应方程式的书写和判断.

练习册系列答案
相关题目
12.下列有关实验操作、现象和解释或结论都正确的是( )
| 实验操作 | 现象 | 解释或结论 | |
| A | 将等体积的CH4和Cl2装入硬质大试管混合后,再将试管倒置于饱和食盐水中,在漫射光的照射下充分反应 | 试管内气体颜色逐渐变浅,试管内壁出现油状液滴 | 甲烷与氯气在光照条件下发生了取代反应 |
| B | 向盛有溴水的两试管中分别加入一定量的乙烯和苯 | 两试管中的水层都逐渐褪色 | 乙烯和苯都与溴水发生了加成反应 |
| C | 向盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸擦干表面煤油的金属钠 | 钠浮在无水乙醇表面,反应比钠在水中更剧烈 | 乙醇结构中羟基氢的活性比水中的强 |
| D | 将乙醇和浓硫酸共热至170℃后,将生成的气体通入酸性KMnO4溶液中 | KMnO4溶液褪色 | 证明乙烯能使KMnO4溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |
10.工业上常用氧化黄铁矿的方法制备硫酸亚铁:2FeS2+7O2+2H2O=2FeSO4+2H2SO4,下列说法正确的是( )
| A. | FeS2既是氧化剂,又是还原剂 | |
| B. | FeSO4溶液保存过程中需加稀硫酸和铁粉,防止变质 | |
| C. | 每生产1molFeSO4,转移的电子数为28NA | |
| D. | 硫酸工业中煅烧黄铁矿,其氧化产物只有SO2 |
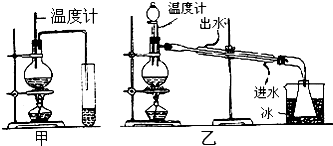
 ;
;