题目内容
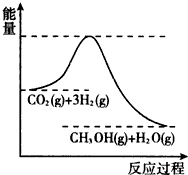 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:(1)上述反应平衡常数K的表达式为
(2)在体积为2L的密闭容器中,充入1mol CO2和3mol H2,测得CO2的物质的量随时间变化如下表所示.从反应开始到5min末,用氢气浓度变化表示的平均反应速率v(H2)=
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
a.增加反应体系压强b、提高反应温度c、增加CO2配比d、降低反应温度e、选择适当的催化剂f、增加H2比.
考点:化学平衡的影响因素,反应速率的定量表示方法
专题:化学平衡专题
分析:(1)依据化学平衡和平衡常数概念书写表达式,图象分析反应是放热反应,温度降低,平衡正向进行;
(2)依据化学反应速率△V=
计算二氧化碳表示的反应速率,结合反应速率之比等于化学方程式计量数之比计算氢气反应速率;
(3)依据影响化学反应速率因素,平衡影响因素的理解,移动原理的分析判断.
(2)依据化学反应速率△V=
| △c |
| △t |
(3)依据影响化学反应速率因素,平衡影响因素的理解,移动原理的分析判断.
解答:
解:(1)CO2(g)+3H2(g)?CH3OH(g)+H2O(g)平衡常数表达式=
,由图象可知反应是放热反应,温度降低,平衡正向进行,平衡常数增大,
故答案为:
;增大;
(2)图表数据分析计算二氧化碳化学反应速率△V=
=
=0.05mol/(L?min),v(H2)=3v(CO2)=3×0.1mol/(L?min)=0.15mol/(L?min);
故答案为:0.15mol/(L?min);
(3)依据影响化学反应速率因素,平衡影响因素的理解,移动原理的分析判断;下列条件能使上述反应速率增大,且平衡向正反应方向移动的;
a.增大压强反应向气体体积减小的正向移动,氢气转化率增大,故a正确;
b.反应是放热反应,适当升高温度,反应速率增大,平衡逆向进行,氢气转化率减小,故b错误;
c、增大CO2配比,平衡正向移动,氢气转化率增大,故c正确;
d、降低温度时,平衡向放热的正向移动,氢气转化率增大,故d正确;
e.选择适当的催化剂,反应速率增大,平衡不动,氢气转化率不变,故e错误;
f.保持容器的容积不变,再充入H2,平衡正向进行,但氢气转化率降低,故f错误;
故答案为:acd.
| [H2O]?[CH3OH] |
| [H2]3?[CO2] |
故答案为:
| [H2O]?[CH3OH] |
| [H2]3?[CO2] |
(2)图表数据分析计算二氧化碳化学反应速率△V=
| △c |
| △t |
| 0.5mol/L-0.25mol/L |
| 5min |
故答案为:0.15mol/(L?min);
(3)依据影响化学反应速率因素,平衡影响因素的理解,移动原理的分析判断;下列条件能使上述反应速率增大,且平衡向正反应方向移动的;
a.增大压强反应向气体体积减小的正向移动,氢气转化率增大,故a正确;
b.反应是放热反应,适当升高温度,反应速率增大,平衡逆向进行,氢气转化率减小,故b错误;
c、增大CO2配比,平衡正向移动,氢气转化率增大,故c正确;
d、降低温度时,平衡向放热的正向移动,氢气转化率增大,故d正确;
e.选择适当的催化剂,反应速率增大,平衡不动,氢气转化率不变,故e错误;
f.保持容器的容积不变,再充入H2,平衡正向进行,但氢气转化率降低,故f错误;
故答案为:acd.
点评:本题考查了化学反应速率,化学平衡常数及转化率相关问题,题目难度中等.

练习册系列答案
相关题目
PHB塑料是一种可在微生物作用下降解的环保型塑料,其结构简式为 ,下面有关PHB说法不正确的是( )
,下面有关PHB说法不正确的是( )
 ,下面有关PHB说法不正确的是( )
,下面有关PHB说法不正确的是( )| A、PHB通过加聚反应制得. |
| B、PHB的单体是CH3CH2CH(OH)COOH |
| C、PHB在微生物作用下的降解产物可能有CO2和H2O |
| D、PHB是一种聚酯 |
下列关于仪器使用的说法正确的是( )
| A、滴定管装滴定液时应先用滴定液润洗 |
| B、锥形瓶用作反应容器时一定不能加热 |
| C、蒸馏时温度计水银球可以高于蒸馏瓶支管口 |
| D、振荡分液漏斗时应关闭其玻璃塞和活塞 |
化学与生产生活、环境密切相关,下列说法不正确的是( )
| A、亚硝酸钠是一种食品防腐剂,但使用时其用量需要加以限制 |
| B、玻璃、陶瓷、水泥都是硅酸盐产品,属于无机非金属材料 |
| C、Na2S可除去废水中Hg2+、Pb2+等重金属离子 |
| D、弱酸性或中性条件下,钢铁腐蚀的正极反应式为:4OH--4e-═O2+2H2O |
下列对有机物结构或性质的描述,错误的是( )
| A、分子式为C3H6O的单官能团的有机物的结构只有三种 |
| B、氰酸铵(NH4OCN)与尿素互为同分异构体 |
| C、甲基丙烯酸甲酯分子式为C5H8O2 |
| D、TNT的化学名称为2,4,6-三硝基甲苯 |
下列化合物中,同分异构体数目超过7个的有( )
| A、已烷 | B、已烯 |
| C、1,2-二溴丙烷 | D、乙酸乙酯 |
能正确表示下列反应的离子反应方程式为( )
| A、NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2 H2O |
| B、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ |
| C、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6 Cl- |
| D、醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
 A、B、C三种物质的转化关系如图所示(部分产物已略去).A是常见的金属单质,通常状况下Y单质是气体,A在Y中燃烧生成棕褐色烟,反应①、②均在水溶液中进行.请回答:
A、B、C三种物质的转化关系如图所示(部分产物已略去).A是常见的金属单质,通常状况下Y单质是气体,A在Y中燃烧生成棕褐色烟,反应①、②均在水溶液中进行.请回答: