题目内容
4.下列关于有机物的说法正确的是( )| A. | 糖类和蛋白质都属于高分子化合物 | B. | 苯和聚乙烯均能发生加成反应 | ||
| C. | C5H11Cl有6种同分异构体 | D. | 石油分馏、煤干馏都可得到烃 |
分析 A.高分子化合物的相对分子质量一般在10000以上;
B.聚乙烯不含碳碳双键;
C.先确定C5H12的同分异构体:正戊烷、异戊烷和新戊烷,然后根据各有机物的结构简式及等效H原子分别判断正戊烷、异戊烷和新戊烷中含有的一氯代物种类即可;
D.石油分馏可得到不同沸点的烃,煤干馏可得到芳香烃.
解答 解:A.糖类中的单糖、二糖不是高分子化合物,故A错误;
B.聚乙烯不含碳碳双键,不能发生加成反应,故B错误;
C.主链有5个碳原子的一氯代物为:CH3CH2CH2CH2CH2Cl、CH3CH2CH2CHClCH3、CH3CH2CHClCH2CH3;
主链有4个碳原子的一氯代物为:CH3CH(CH3)CH2CH2Cl、CH3CH(CH3)CHClCH3、CH3CCl(CH3)CH2CH3;CH2ClCH(CH3)CH2CH3;
主链有3个碳原子的一氯代物为:CH2C(CH3)2CH2Cl,
根据分析可知,C5H11Cl的同分异构体总共有8种,故C错误;
D.石油为多种烃的混合物,分馏可得到不同沸点的烃,煤干馏可得到芳香烃等,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,侧重考查学生的分析能力,把握常见有机物的结构、官能团、性质及反应类型为解答的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列热化学方程式书写正确的是( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1 367.0 kJ•mol-1(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.3 kJ•mol-1(中和热) | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ•mol-1(反应热) | |
| D. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=+110.5 kJ•mol-1(燃烧热) |
15.工业上在一定条件下将丙烷脱氢制丙烯.
(1)反应过程中能量变化如图1所示,下列有关叙述正确的是ac.
a.此反应为吸热反应
b.催化剂能改变反应的焓变和活化能
c.E1表示正反应的活化能,E2表示逆反应的活化能
d.有催化剂能加快反应速率,提高丙烷的转化率
(2)上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为K=$\frac{c(C{H}_{2}=C{H}_{2})c({H}_{2})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$.若升温,该反应的平衡常数增大(填“增大”、“减小”或“不变”).若向上述反应达到平衡的容器内再通入少量丙烷,则$\frac{c(C{H}_{2}=CHC{H}_{3})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$减小(填“增大”、“减小”或“不变”).
(3)在0.1MPa、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是此反应是气体体积和增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率.

(4)上述反应生成物丙烯经多步氧化生成丙酸,已知常温下Ka(CH3CH2COOH)=1.3×10-5.Kb(NH3•H2O)=1.8×10-5.
①用离子方程式表示CH3CH2COONa溶液显碱性的原因CH3CH2COO-+H2O?CH3COOH+OH-.
②常温下,若丙酸与氨水混合后溶液呈中性,则溶液中$\frac{c(C{H}_{3}C{H}_{2}CO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.3×109.
(5)已知:
则丙烷脱氢反应的热化学方程式为CH3CH2CH3(g)?CH2=CHCH3(g)+H2(g)△H=+126kJ/mol.
(1)反应过程中能量变化如图1所示,下列有关叙述正确的是ac.
a.此反应为吸热反应
b.催化剂能改变反应的焓变和活化能
c.E1表示正反应的活化能,E2表示逆反应的活化能
d.有催化剂能加快反应速率,提高丙烷的转化率
(2)上述反应在恒温恒容密闭容器中达到平衡,其平衡常数K的表达式为K=$\frac{c(C{H}_{2}=C{H}_{2})c({H}_{2})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$.若升温,该反应的平衡常数增大(填“增大”、“减小”或“不变”).若向上述反应达到平衡的容器内再通入少量丙烷,则$\frac{c(C{H}_{2}=CHC{H}_{3})}{c(C{H}_{3}C{H}_{2}C{H}_{3})}$减小(填“增大”、“减小”或“不变”).
(3)在0.1MPa、800K条件下,向恒容密闭容器中通入丙烷和稀有气体,丙烷脱氢反应的转化率随着稀有气体与丙烷比例的变化情况如图2所示,则随着稀有气体与丙烷比例的增加,丙烷转化率逐渐增大的原因是此反应是气体体积和增加的反应,随着稀有气体比例的增加,降低了反应体系各气体的分压,相当于减压,从而促进反应向正反应方向进行,提高了丙烷脱氢的转化率.

(4)上述反应生成物丙烯经多步氧化生成丙酸,已知常温下Ka(CH3CH2COOH)=1.3×10-5.Kb(NH3•H2O)=1.8×10-5.
①用离子方程式表示CH3CH2COONa溶液显碱性的原因CH3CH2COO-+H2O?CH3COOH+OH-.
②常温下,若丙酸与氨水混合后溶液呈中性,则溶液中$\frac{c(C{H}_{3}C{H}_{2}CO{O}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=1.3×109.
(5)已知:
| 化学键 | H-H | C-H | C-C | C=C |
| 键能(kJ•mol-1) | 436 | 413 | 348 | 612 |
12.硫可以形成分子式为S2、S4、S6、S8的单质,其中S8的分子结构如图所示.下列有关说法正确的是( )
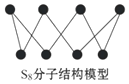

| A. | S2、S4、S6、S8互为同位素 | |
| B. | S2的摩尔质量为32 g/mol | |
| C. | 硫的单质在足量的空气中完全燃烧可生成SO3 | |
| D. | 1 mol S8单质中含有的S-S键个数为8NA |
19.工业上用FeCl3溶液腐蚀印刷电路板,向腐蚀后的溶液中(含Fe3+、Cu2+、Fe2+、H+、Cl-等离子)加入指定物质,反应后溶液中大量存在的一组离子描述正确的是( )
| A. | 加入过量Fe:Fe2+、Fe3+、Cl-、H+ | |
| B. | 加入过量H2O2和稀盐酸:Fe3+、Cu2+、H+、Cl- | |
| C. | 加入过量新制氯水:Fe3+、Cu2+、H+、Cl- | |
| D. | 加入过量CuO:Fe3+、Cu2+、H+、Cl- |
9.下列盐溶液呈中性的是( )
| A. | NaHCO3 | B. | NH4C1 | C. | KNO3 | D. | CH3COONa |
18.一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)?CH3OH(g)达到平衡,下列说法正确的是( )
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应放热 | |
| B. | 达到平衡时,容器I中反应物转化率比容器Ⅱ中的小 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的正反应速率比容器I中的大 |
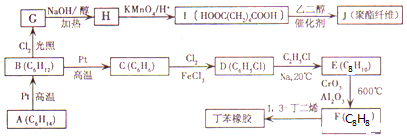
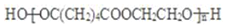 .
.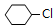 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$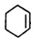 +NaCl+H2O.
+NaCl+H2O.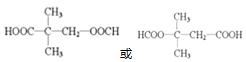 (写出其中一种的结构简式).
(写出其中一种的结构简式).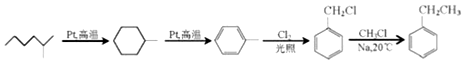 .
.