题目内容
7.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下: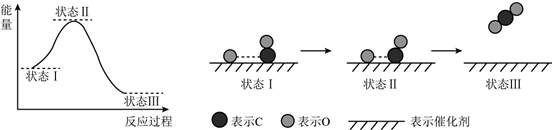
下列说法正确的是( )
| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 | |
| D. | CO和O生成了具有极性共价键的CO2 |
分析 由图可知反应物总能量大于生成物总能量,为放热反应,CO与O在催化剂表面形成CO2,不存在CO的断键过程,以此解答该题.
解答 解:A.由图可知反应物总能量大于生成物总能量,为放热反应,故A错误;
B.由图可知不存在CO的断键过程,故B错误;
C.状态Ⅰ→状态Ⅲ表示CO与O反应的过程,而不是与氧气反应,故C错误.
D.CO与O在催化剂表面形成CO2,CO2含有极性共价键,故D正确;
故选D.
点评 本题侧重于化学反应原理的探究的考查,题目着重于考查学生的分析能力和自学能力,注意把握题给信息,难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
8.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在另一边镀二氧化锰.在纸内是离子“流过”水和氧化锌组成的电解液.电池的总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH).下列说法正确的是( )
| A. | 该电池的正极为锌 | |
| B. | 该电池的反应中二氧化锰起催化作用 | |
| C. | 当0.1 mol Zn完全溶解时,流经电解液的电子个数约为1.204×1023 | |
| D. | 电池的正极反应式为:2MnO2+2H2O+2e=2MnO(OH)+2OH |
18.(1)图中为常 见仪器的部分结构(有的仪器被放大)
图A中液面所示溶液的体积为28.0mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为AmL,仰视时读数为B mL,若B>A,则所使用的仪器是C(填字母标号).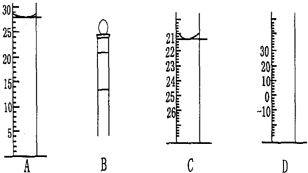
(2)有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处.把滴定管中的溶液全部排出,承接在量筒中,量筒内溶液的体积A.
A、大于40.00ml B、为40.00ml C、小于40.00ml D、为10.00ml
(3)下列有关实验操作或结果的说法中正确的是CE(填字母)
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.用碱式滴定管量取0.10mol•L-1的KMnO4溶液15.10mL
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
(4)某同学用中和滴定法测定某烧碱样品的纯度,其操作步骤如下:
①称取25.0g烧碱样品,配成1L溶液;
②用碱式滴定管(填仪器名称)量取10.00mL配制好的溶液于锥形瓶中,向其中滴加入几滴酚酞,用0.20mol•L-1的标准盐酸滴定(杂质不与盐酸反应),当出现溶液由红色变为无色,30s不恢复红色现象时说明达到滴定终点.滴定过程所得数据如下表:
③实验过程中,配制溶液定容时俯视刻度线会使所配溶液浓度偏大(填“偏大”“偏小”或“无影响”,下同);滴定前仰视液面,滴定后平视液面会使烧碱样品纯度的测量值比实际值偏大;
④三组数据中,因误差过大而应舍去的一组是第2组(填序号),根据合理数据求得该烧碱样品中NaOH的质量分数为80%.
图A中液面所示溶液的体积为28.0mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为AmL,仰视时读数为B mL,若B>A,则所使用的仪器是C(填字母标号).

(2)有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10.00mL刻度处.把滴定管中的溶液全部排出,承接在量筒中,量筒内溶液的体积A.
A、大于40.00ml B、为40.00ml C、小于40.00ml D、为10.00ml
(3)下列有关实验操作或结果的说法中正确的是CE(填字母)
A.滴定时,眼睛应始终注视滴定管内液面的变化
B.用碱式滴定管量取0.10mol•L-1的KMnO4溶液15.10mL
C.酸碱中和滴定之前,锥形瓶用蒸馏水洗净即可,不能用待测液润洗
D.用pH试纸测量某溶液的pH时要先将试纸润湿
E.滴定管经蒸馏水洗净后,直接注入标准液,将使测得的待测液浓度偏高
(4)某同学用中和滴定法测定某烧碱样品的纯度,其操作步骤如下:
①称取25.0g烧碱样品,配成1L溶液;
②用碱式滴定管(填仪器名称)量取10.00mL配制好的溶液于锥形瓶中,向其中滴加入几滴酚酞,用0.20mol•L-1的标准盐酸滴定(杂质不与盐酸反应),当出现溶液由红色变为无色,30s不恢复红色现象时说明达到滴定终点.滴定过程所得数据如下表:
| 滴定序 号 | 待测液体积/mL | 所消耗盐酸标准液的体积/mL | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.52 | 25.02 |
| 2 | V | 0.40 | 24.40 | 24.00 |
| 3 | V | 1.00 | 25.98 | 24.98 |
④三组数据中,因误差过大而应舍去的一组是第2组(填序号),根据合理数据求得该烧碱样品中NaOH的质量分数为80%.
2.下列叙述错误的是( )
| A. | 通常情况下,甲烷跟强酸、强碱、强氧化剂不反应 | |
| B. | 甲烷化学性质比较稳定,不能被任何氧化剂氧化 | |
| C. | 甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHC13还是CCl4,都是取代反应 | |
| D. | 常温下CH3Cl为气体 |
16.下列共价键中,属于非极性键的是( )
| A. | C-H | B. | C-Cl | C. | C═O | D. | N≡N |
17.乙醇分子中各种化学键如图所示.下列有关反应断键位置说明错误的是( )


| A. | 乙醇和浓硫酸,共热到170℃时断键②⑤ | |
| B. | 乙醇和浓硫酸,共热到140℃时断键①④ | |
| C. | 乙醇和金属钠的反应断键① | |
| D. | 乙醇在Cu催化下与O2反应时断键①③ |
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
.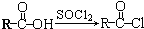 .
.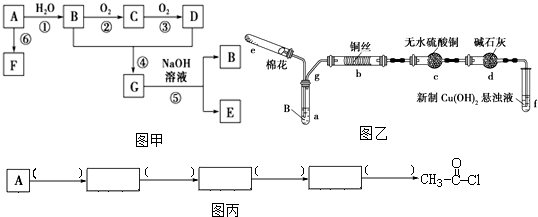
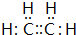 .
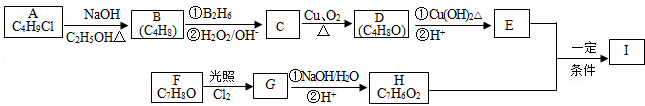
.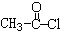 的合成路线如图丙(无机试剂任选).请在( )内填上所需试剂,□内填上合成过程的中间产物.
的合成路线如图丙(无机试剂任选).请在( )内填上所需试剂,□内填上合成过程的中间产物.