题目内容
8.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在另一边镀二氧化锰.在纸内是离子“流过”水和氧化锌组成的电解液.电池的总反应为Zn+2MnO2+H2O=ZnO+2MnO(OH).下列说法正确的是( )| A. | 该电池的正极为锌 | |
| B. | 该电池的反应中二氧化锰起催化作用 | |
| C. | 当0.1 mol Zn完全溶解时,流经电解液的电子个数约为1.204×1023 | |
| D. | 电池的正极反应式为:2MnO2+2H2O+2e=2MnO(OH)+2OH |
分析 由电池总反应Zn+2MnO2+H2O═ZnO+2MnO(OH)可知,Zn被氧化,为原电池的负极,电极反应为Zn-2e-+2OH-═ZnO+H2O,MnO2被还原,为原电池的正极,电极反应为MnO2+H2O+e-═MnO(OH)+OH-.
解答 解:A、从电池反应可知,锌被氧化,失去电子,所以是负极,故A错误;
B、该电池反应中二氧化锰发生了还原反应,二氧化锰得到电子,被还原,为原电池的正极,而不是催化剂,故B错误;
C、当有0.1mol锌溶解时,失去电子数为0.1×2×6.02×1023=1.204×1023,但电子由负极经外电路流向正极,不流经电解液,故C错误;
D、电池的正极反应式为MnO2+H2O+e-═MnO(OH)+OH-,或2MnO2+2e-+2H2O═2MnO(OH)+2OH-,故D正确;
故选:D.
点评 本题考查新型化学电源,侧重于电极反应方程式的考查,题目难度中等,注意从正负极发生的变化并结合电解质的特点书写电极反应式.本题易错点为C,注意电子与溶液中离子的移动的区别.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
18.下列说法正确的是( )
| A. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| B. | 新制氯水中的所有物质都是电解质 | |
| C. | 氮氧化物、二氧化硫是形成酸雨的主要物质 | |
| D. | 制造光导纤维的原料是晶体硅 |
16.某学生用化学知识解决生活中的问题,下列家庭小实验或说法不合理的是( )
| A. | 用米汤检验食盐中是否含碘酸钾(KIO3) | |
| B. | 用食醋除去暖水瓶中的薄层水垢 | |
| C. | 医用酒精的浓度通常为75%,可用于杀菌消毒 | |
| D. | 用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
3.R+的结构示意图为 ,则R元素在元素周期表中位于( )
,则R元素在元素周期表中位于( )
 ,则R元素在元素周期表中位于( )
,则R元素在元素周期表中位于( )| A. | 第三周期0族 | B. | 第四周期IA族 | C. | 第三周期IA族 | D. | 第三周期VIIA族 |
6.镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成.放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁.由于电池使用后电极材料对环境有危害,某学习小组对该电池电极材料进行回收研究.
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
回答下列问题:
(1)该电池的负极材料是Fe正极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位),(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+,过滤,在滤液中个慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+.
②某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 3.8 | - |
| Fe(OH)3 | 4.0×10-38 | 1.9 | 3.2 |
| Fe(OH)2 | 8.0×10-15 | 6.95 | 9.95 |
| Ni(OH)2 | 6.5×10-18 | 5.9 | 8.9 |
(1)该电池的负极材料是Fe正极反应式为NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)若电池输出电压为3V,给2W灯泡供电,当电池消耗0.02gFe,理论上电池工作1.72min(小数点后保留2位),(已知F=96500C/mol)
(3)将电池电极材料用盐酸溶解后加入适量双氧水,其目的是将溶液中的Fe2+氧化为Fe3+,过滤,在滤液中个慢慢加入NiO固体,则开始析出沉淀时的离子方程式是NiO+2H+=Ni2++H2O和Fe3++3H2O=Fe(OH)3↓+3H+.若将两种杂质阳离子都沉淀析出,pH应控制在5.1~5.9之间(离子浓度小于或等于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.5);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3
(4)将加入NiO过滤后的溶液加入Na2C2O4,得到NiC2O4•2H2O和滤液A,A的主要成分是NaCl溶液;电解滤液A,在阴极产生气体BH2(填分子式);在阳极产生气体CCl2(填分子式).将NiC2O4•2H2O加入到电解后的溶液,再通入电解时某电解产生的气体,即可得到回收产品Ni(OH)3,所通入气体为C(填“B”、“C”)极气体,判断依据是要实现Ni(OH)2→Ni(OH)3,镍元素化合价升高,需要加入氧化剂,则通入的气体应为阳极产生的Cl2.
7.最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:
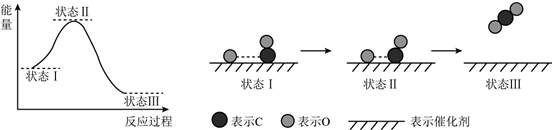
下列说法正确的是( )

下列说法正确的是( )
| A. | CO和O生成CO2是吸热反应 | |
| B. | 在该过程中,CO断键形成C和O | |
| C. | 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 | |
| D. | CO和O生成了具有极性共价键的CO2 |
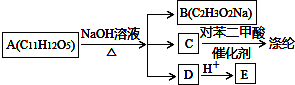


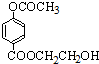 或
或
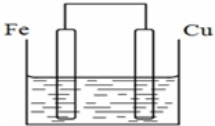 若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如图,一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为0.02mol.
若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如图,一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为0.02mol.