题目内容
标准状况下,氢气和一氧化氮的混合气体共8.96升,测得其质量为6克,请计算该混合气体中氢气和一氧化氮的质量和体积分别是多少.
考点:阿伏加德罗定律及推论
专题:阿伏加德罗常数和阿伏加德罗定律
分析:根据n=
计算出标况下8.96L混合气体的物质的量,然后分别设出氢气和一氧化氮的物质的量,根据质量和物质的量列式计算出二者物质的量,然后分别根据m=nM、V=nVm进行计算.
| V |
| Vm |
解答:
解:标况下8.96L氢气和一氧化氮的混合气体的物质的量为:
=0.4mol,
设氢气的物质的量为xmol、一氧化氮的物质的量为ymol,
根据质量可得:①2x+30y=6,根据物质的量可得:②x+y=0.4,根据①②联立解得:x=0.214、y=0.186,
则混合气体中氢气的质量为:2g/mol×0.214mol=0.428g,标况下氢气的体积为:22.4L/mol×0.214mol≈4.8L,
混合气体中NO的质量为:6g-0.428g=5.572g,标况下NO的体积为:8.96L-4.8L=4.16L,
答:该混合气体中氢气的质量为0.42g、体积为4.8L,一氧化氮的质量为5.572g、体积为4.16L.
| 8.96L |
| 22.4L/mol |
设氢气的物质的量为xmol、一氧化氮的物质的量为ymol,
根据质量可得:①2x+30y=6,根据物质的量可得:②x+y=0.4,根据①②联立解得:x=0.214、y=0.186,
则混合气体中氢气的质量为:2g/mol×0.214mol=0.428g,标况下氢气的体积为:22.4L/mol×0.214mol≈4.8L,
混合气体中NO的质量为:6g-0.428g=5.572g,标况下NO的体积为:8.96L-4.8L=4.16L,
答:该混合气体中氢气的质量为0.42g、体积为4.8L,一氧化氮的质量为5.572g、体积为4.16L.
点评:本题考查了阿伏伽德罗常定律的应用,题目难度中等,明确物质的量与标况下气体摩尔体积的关系为解答关键,注意掌握阿伏伽德罗定律的内容及应用方法.

练习册系列答案
相关题目
氨基钠和氢化钠与水反应的化学方程式如下:①NaNH2+H2O=NaOH+NH3↑②NaH+H2O=NaOH+H2↑.下列叙述正确的是( )
| A、方程式②中,每生成1mol H2转移2 mol电子 |
| B、①和②两个反应都是氧化还原反应 |
| C、氨基钠和氢化钠与盐酸反应都只生成一种盐 |
| D、氨基钠和氢化钠晶体中都有离子键 |
若甲、乙两物质互为同系物,则下列说法不正确的是( )
| A、甲、乙的结构必然相同 |
| B、甲、乙的组成元素必然相同 |
| C、甲、乙的化学性质相似 |
| D、甲乙的相对分子质量必然相差14n(n为正整数) |
下列排序正确的是( )
| A、微粒半径:Fe(OH)3胶粒<K+<S2- |
| B、热稳定性:PH3<NH3<H2O |
| C、碱性:Mg(OH)2<Al(OH)3<NaOH |
| D、熔点:CaCl2<SO3<SiC |
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 氢氧化钡 | 蔗糖溶液 | 硫酸钡 | 醋酸 | 氢气 |
| B | 胆矾 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| C | 盐酸 | 石灰水 | 苛性钾 | 水 | 氨气 |
| D | 石灰石 | 水玻璃 | 氯化钙 | 氢氧化铁 | 碳酸钙 |
| A、A | B、B | C、C | D、D |
下列图示与对应的叙述相符的是( )


| A、图l表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
| B、图2中纯水仅升高温度,就可以从a点变到c点 |
| C、图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性 |
| D、用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol?L-1 Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl- |
下列实验方案正确且能达到相应实验预期目的是( )
A、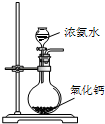 制备少量氨气 |
B、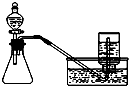 用铜和浓硝酸制取少量NO2 |
C、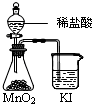 比较MnO2、Cl2、I2的氧化性 |
D、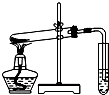 探究NaHCO3的热稳定性 |
