题目内容
15.将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是 g)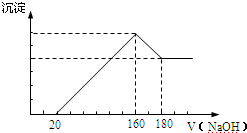
求:
(1)加入NaOH溶液0--20mL过程中反应方程式为:HCl+NaOH═NaCl+H2O.160--180mL过程中反应方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
(2)消耗NaOH溶液160mL时,所得溶液中的离子有Na+ Cl-,沉淀中Al(OH)3的质量7.8g
(3)合金中Mg的质量为4.8g.所用HCl 的物质的量浓度为8mol/L.
分析 (1)由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,再加氢氧化钠,氢氧化铝溶解,据此回答;
(2)加160mL的NaOH溶液时,溶液中的溶质为NaCl,由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,再加氢氧化钠,氢氧化铝溶解,所以最后的11.6g沉淀就是氢氧化镁,由元素守恒可知n(Mg)=n[Mg(OH)2],可以计算含有的金属镁和金属铝的物质的量,根据铝元素守恒计算产生氢氧化铝的量;
(3)由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,再加氢氧化钠,氢氧化铝溶解,所以最后的11.6g沉淀就是氢氧化镁,由元素守恒可知n(Mg)=n[Mg(OH)2],再利用m=nM计算Mg的质量;加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再计算盐酸的物质的量浓度.
解答 解:(1)由图可知,加入NaOH溶液0-20mL过程中没有沉淀,发生的反应方程式为:HCl+NaOH═NaCl+H2O,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,再加氢氧化钠,氢氧化铝溶解,发生反应:Al(OH)3+NaOH═NaAlO2+2H2O,故答案为:HCl+NaOH═NaCl+H2O;Al(OH)3+NaOH═NaAlO2+2H2O;
(2)加160mL的NaOH溶液时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中的溶质为NaCl,再加氢氧化钠,氢氧化铝溶解,所以最后的11.6g沉淀就是氢氧化镁,所以得到氢氧化铝沉淀是19.4g-11.6g=7.8g,根据Al元素守恒,所以得到氢氧化铝沉淀的质量是7.8g,故答案为:Na+、Cl-;7.8;
(3)由图可知,从加入20m氢氧化钠溶液L开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,再加氢氧化钠,氢氧化铝溶解,所以最后的11.6g沉淀就是氢氧化镁,即n[Mg(OH)2]=0.2mol,由元素守恒可知n(Mg)=n[Mg(OH)2]=0.2mol,所以Mg的质量为0.2mol×24g/mol=4.8g,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×5mol/L=0.8mol,根据氯元素守恒n(HCl)=0.8mol,故盐酸的物质的量浓度为$\frac{0.8mol}{0.1L}$=8mol/L.
故答案为:4.8;8.
点评 本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算.

| W | 单质是淡黄色固体 |
| X | 在地壳中的含量居第二位 |
| Y | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| Z | 第三周期原子半径最小的金属元素 |
| A. | 气态氢化物的热稳定性:X>W | |
| B. | 最高价氧化物对应水化物的酸性:Y>X | |
| C. | 离子半径:Z>W | |
| D. | Z 的氧化物不具有两性 |
| A. | 滴定终点时溶液由无色变为浅红色且保持半分钟颜色不变 | |
| B. | 滴定终点时混合溶液的pH=7 | |
| C. | 滴定终点时反应的热效应即为中和热 | |
| D. | 滴定终点时两者恰好完全反应 |
| A. | 2 | B. | 3 | C. | 4 | D. | 6 |
| A. | 1L 0.1mol•L-1氨水中有NA个NH4+ | |
| B. | 常温常压下,22.4 L CO2中含有NA个CO2分子 | |
| C. | 1L 0.1mol•L-1Na2SO3溶液中含有 0.1NA个SO32- | |
| D. | 1L 0.1mol•L-1AlCl3溶液中含有氯离子数为0.3NA |
| A. | 甲苯与氯气在光照下反应主要生成2,4,6-三氯甲苯 | |
| B. | 苯乙烯在一定条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴水反应生成1,2-二溴乙烷 | |
| D. | 苯与浓硝酸、浓硫酸共热并保持55~60℃反应生成硝基苯 |