题目内容
5.现有CuO、FeO、Fe2O3组成的混合物m g,向其中加入100mL 1mol•L-1硫酸,恰好完全溶解,若m g该混合物在过量氢气流中加热充分反应,则冷却后剩余固体的质量为( )| A. | (m-0.1)g | B. | (m-0.8)g | C. | (m-1.2)g | D. | (m-1.6)g |
分析 金属氧化物与硫酸反应生成硫酸盐和水,由反应CuO~CuSO4,FeO~FeSO4,Fe2O3~Fe2(SO4)3,可知H2SO4的物质的量等于金属氧化物中O元素的物质的量,据此计算金属氧化物中氧元素的质量,金属氧化物的质量减去氧的质量即为金属的质量.
解答 解:由反应CuO~CuSO4,FeO~FeSO4,Fe2O3~Fe2(SO4)3,可知H2SO4的物质的量等于金属氧化物中O元素的物质的量,n(H2SO4)=0.1L×1mol/L=0.1mol,
所以金属氧化物中O的质量为:0.1mol×16g/mol=1.6g,
若将mg原混合物在足量氢气中加热,使其充分反应,冷却后剩余固体为金属单质,
则金属质量为氧化物的质量减去氧的质量,
所以冷却后剩余金属质量=mg-1.6g=(m-1.6)g,
故选D.
点评 本题考查混合物反应的计算,题目难度中等,注意根据反应的特点,确定金属氧化物与硫酸反应的关系式,从而得出硫酸的物质的量与金属氧化物中O氧原子物质的量相等,是解答该题的关键,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
16.一定温度下,在2.5L的恒容密闭容器中发生如下反应:CO2(g)+H2S(g)?COS(g)+H2O(g)
下列说法不正确的是( )
| 实验 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
| CO2 | H2S | H2O | |||
| Ⅰ | 607 | 0.11 | 0.41 | 0.01 | |
| Ⅱ | 607 | 0.22 | 0.82 | ||
| Ⅲ | 620 | 0.1 | 0.4 | 6.74×10-3 | |
| A. | 该反应正反应为吸热反应 | |
| B. | 607K时,把物质的量均为0.1mol四种反应物加入该反应器中,反应将向正反应方向进行 | |
| C. | 实验Ⅱ达到平衡时容器中COS的物质的量为0.02mol | |
| D. | 实验Ⅲ中,无论是开始还是至化学平衡状态,混合气体的密度始终不变 |
20.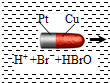 一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )
一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )
 一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )
一种子弹头形的纳米铜铂电池,它在稀溴水中能沿着铜极方向移动(如图),电池反应为:Cu+Br2=CuBr2.下列说法正确的是( )| A. | 铜为电池的正极 | |
| B. | 铂不断溶解 | |
| C. | 稀溴水为电解质溶液 | |
| D. | 电池工作时实现机械能向电能再向化学能转化 |
10.下列关于Na2O2的叙述正确的是( )
| A. | Na2O2是淡黄色固体,久置于空气中变成Na2O | |
| B. | Na2O2与水的反应中,Na2O2只作氧化剂 | |
| C. | 用Na2O2漂白过的织物、麦杆等日久又渐渐变成黄色 | |
| D. | Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |
17.下列物质中最简式相同,但既不是同系物,也不是同分异构体的是( )
| A. | CH3CH═CH2和 | B. | 乙炔和苯 | C. |  和 和 | D. | 苯和苯酚 |
14.下列混合物的分离和提纯方法中,主要是从溶解性角度考虑的是( )
①过滤 ②蒸发 ③蒸馏 ④萃取.
①过滤 ②蒸发 ③蒸馏 ④萃取.
| A. | ①② | B. | ①④ | C. | ③④ | D. | ②③ |
15.某学生用碱式滴定管量取0.1000mol•L-1 的NaOH溶液,开始时仰视液面读数为1.00mL,取出部分溶液后,俯视液面,读数为11.00mL,该同学在操作中实际取出的液体体积为( )
| A. | 大于10.00mL | B. | 小于10.00mL | C. | 等于10.00mL | D. | 等于11.00mL |
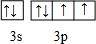 .
.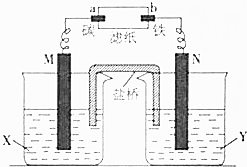 根据反应:Zn+CuSO4═Cu+ZnSO4设计原电池进行如图所示实验,滤纸上滴有酚酞和氯化钠溶液.实验进行一段时间后,在b电极附近出现红色.请回答下列问题:
根据反应:Zn+CuSO4═Cu+ZnSO4设计原电池进行如图所示实验,滤纸上滴有酚酞和氯化钠溶液.实验进行一段时间后,在b电极附近出现红色.请回答下列问题: